Метод молекулярных орбиталей. Химикам известно довольно много объектов, химическое строение которых в принципе не может быть описано с позиций МВС.
Химикам известно довольно много объектов, химическое строение которых в принципе не может быть описано с позиций МВС.
Пример №1. Известно, что молекулярный ион H2+ - устойчивая частица. Каким образом здесь осуществляется ковалентная хим. связь, если в данной частице присутствует только 1 электрон?
Пример №2. Простейший бороводород BH3 не существует, т.к. в момент образования он мгновенно димеризуется в молекулу B2H6. Каким образом здесь осуществляется ковалентная хим. связь, если каждый атом водорода одновалентен, а каждый атом бора должен быть трехвалентным (у бора 3 валентных электрона)?
Пример №3. По МВС молекулы О2 не должна содержать неспаренные электроны. Такие молекулы должны проявлять диамагнитные свойства (выталкиваться из магнитного поля). Эксперимент показывает обратное: молекулы О2 втягиваются в магнитное поле Þ О2 парамагнитна, т.е. содержит 1 или несколько неспаренных электронов.
И таких примеров можно привести еще немало. Все эти явления легко объяснимы в рамках другого квантовомеханического способа описания хим.связи – ММО.
В ММО молекула (или любая другая частица) рассматривается как единое целое.
Фактически, ММО рассматривает молекулу как «многоядерный атом». Другими словами: при образовании молекулы исходные атомы исчезают, т.к. превращаются в «многоядерный атом». В таком «многоядерном атоме» тоже существуют орбитали, которые называются молекулярными орбиталями (МО).
МО получаются при взаимодействии АО исходных атомов.
МО отличаются от АО по энергии, форме и ориентации в пространстве (напрашивается аналогия с ГАО, но она мнимая).
В образовании каждой МО молекулы принимают участие все исходные АО всех атомов, объединяющихся в молекулу. Но вклад каждой АО в образование данной МО различен. Наиболее сильно взаимодействуют АО, которые:
а) близки по энергии
б) имеют одинаковую форму (s+s, p+p, d+d)
в) одинаково ориентированы в пространстве (px+px, py+py и т.д.).
При образовании МО соблюдается правило сохранения количества орбиталей: количество получившихся МО = количеству исходных АО.
Результатом расчета по ММО является энергетическая диаграмма, которая показывает взаимное расположение энергетических уровней МО относительно исходных АО.
Пример: энергетическая диаграмма для молекулы H2

МО, которые имеют энергию ниже, чем исходные АО называются связывающими.
МО, имеющие энергию выше, чем исходные АО называются разрыхляющими (*).
Заполнение МО электронами МО осуществляется по тем же законам, как и в атоме:
1. Принцип наименьшей энергии.
2. Принцип Паули.
3. Правило Хунда.
В ММО невозможно определить число связей между атомами в молекуле (химическая связь в ММО является понятием несчетным!). Вместо этого здесь используется понятие о порядке связи (ПС):
ПС=(Nсв-Nразр)/m ,
где: Nсв - кол-во электронов на СМО,
Nразр - кол-во электронов на РМО,
m - кол-во ядер в молекуле.
Чем больше ПС, тем крепче, прочнее частица (молекула, ион, радикал).
Если ПС ≤ 0, то связи вообще нет, т.е. данная частица существовать не может.
Например: ПС (H2) = (2-0)/2 = 1 Þ молекула H2 устойчивая частица.
Далее разобрать:
ПС (H2+) = (1-0)/2 = 1/2 > 0 Þ H2+ устойчивая частица
ПС (H2+2) = (0-0)/2 = 0 Þ H2+2 не существует
ПС (H2-) = (2-1)/2 = 1/2 > 0 Þ H2- устойчивая частица
ПС (H2-2) = (2-2)/2 = 0 Þ H2-2 не существует
Тема 4. Скорость химических реакций, основные понятия термодинамики
Химическая кинетика - это раздел химии, изучающий скорости химических реакций и их механизм. Все химические взаимодействия можно разделить на гомогенные и гетерогенные.
Гомогенные реакции - это процессы, протекающие по всему объему смеси реагирующих веществ. Любая реакция, идущая в смеси газов, смеси жидкостей или в смеси жидких растворов является гомогенной. Например, если смешать газообразные водород и хлор, а затем эту смесь нагреть, то пойдет гомогенное взаимодействие по уравнению Н2 + Сl2 = 2НСl.
Гетерогенные реакции - это процессы, протекающие на границе раздела между взаимодействующими веществами. Например, горение углерода в кислороде является гетерогенным процессом: C + O2 = CO2 . Эта реакция протекает на поверхности раздела двух фаз (твердый углерод - газообразный кислород).
Скорость химической реакции - это количество элементарных актов химического взаимодействия за единицу времени. Для гомогенной реакции скорость (v) можно определить как изменение концентрации одного из исходных веществ или продуктов за единицу времени:
v =  ,
,
где: D С - изменение концентрации одного из веществ (исходного или продукта); D t - промежуток времени, за который произошло это изменение.
Для гетерогенных реакций в данном определении параметр D С следует заменить на D n  (изменение количества вещества одного из реагентов или продуктов реакции). В приведенном выше уравнении имеет место модуль, т.к. скорость химической реакции не может быть отрицательной величиной.
(изменение количества вещества одного из реагентов или продуктов реакции). В приведенном выше уравнении имеет место модуль, т.к. скорость химической реакции не может быть отрицательной величиной.
Величина скорости гомогенной реакции определяется 4 факторами:
1. Природой реагирующих веществ.
2. Концентрацией реагирующих веществ.
3. Температурой.
4. Наличием в системе того или иного катализатора.
Природа реагирующих веществ.
Это, пожалуй, самый главный параметр, который определяет не только скорость взаимодействия, но и саму возможность протекания реакции. Так, например, цезий при соприкосновении с горячей водой взрывается. Литий взаимодействует с горячей водой достаточно активно, но без взрыва. С той же горячей водой магний взаимодействует очень вяло, а медь - вообще не взаимодействует. К сожалению, математическая зависимость скорости химической реакции от природы реагентов в настоящее время неизвестна. Поэтому, здесь можно рассуждать только на качественном уровне.
Концентрация реагирующих веществ.
Зависимость скорости реакции от концентрации выражается законом действия масс:
cкорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени, равные стехиометрическим коэффициентам (т.е. тем коэффициентам, которые пишутся в уравнении реакции перед формулами веществ).
nA + mB = An Bm ;
v = k × [A]n × [B]m ,
где v - скорость реакции при постоянной температуре; [A] - концентрация исходного вещества А (моль/дм3); [B] - концентрация исходного вещества В (моль/дм3); k - константа скорости реакции.
Константа скорости в уравнении закона действующих масс является константой только по одному параметру - концентрации. Величина константы скорости реакции определяется природой веществ А и В, температурой и катализатором (если он введен в систему). Другими словами, в константе скорости ”спрятана” зависимость скорости реакции от всех факторов, кроме концентрации реагирующих веществ.
Следует учесть, что приведенное выше уравнение является верным, если данное взаимодействие протекает в одну стадию. Если реакция идет через ряд промежуточных стадий, общая скорость реакции равна скорости самой медленной стадии процесса (для этого необходимо знать реальный механизм данного взаимодействия). В дальнейшем, для простоты, будем считать все рассматриваемые процессы одностадийными.
Примеры: 1) H2(г) + J2(г) = 2 HJ(г) (гомогенная реакция)
v1 = k1 [H2] [J2] .
2) 2 СO(г) + O2(г) = 2 СO2(г) (гомогенная реакция)
v2 = k2 [CO]2 [O2] .
3) C(т) + O2(г) = CO2(г) (гетерогенная реакция)
v3 = k3 [O2] .
В последнем примере концентрацию твердого углерода изменить нельзя (по сути, это его плотность, выраженная в единицах моль/дм3). Поэтому величина [С(т)] входит в константу скорости k3 .
Температура.
Скорость химической реакции очень сильно зависит от температуры, при которой происходит взаимодействие веществ: чем выше температура, тем быстрее идет это взаимодействие. Математически эта зависимость может быть задана двумя способами: правилом Вант-Гоффа и уравнением Аррениуса.
Правило Вант-Гоффа: cкорости большинства химических реакций увеличиваются в 2 - 4 раза при увеличении температуры на каждые 10 °С.
(t2 - t1) / 10°
v (t2) = v (t1) × ¡ ,
где v (t1) - скорость реакции при температуре t1 ; v (t2) - скорость реакции при температуре t2 ; ¡ - температурный коэффициент Вант-Гоффа (показывает, во сколько раз увеличивается скорость данной реакции при D t = t2 - t1 = 10 °C); t1 и t2 - начальная и конечная температуры, при которых измерялась скорость реакции.
Пример: температурный коэффициент некоторой реакции равен 2. Во сколько возрастет скорость этой реакции при увеличении температуры от 20 до 120 °С ?
(t2 - t1) / 10°
v (t2) = v (t1) ס ;
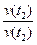 =
= 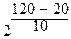 =
= 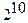 = 1024 .
= 1024 .
Ответ: скорость данной реакции увеличится в 1024 раза.
Правило Вант-Гоффа найдено экспериментально и не является законом. Температурный коэффициент (¡) для большинства химических реакций имеет постоянное значение только в довольно узком интервале температур (как правило, D t не более 100 °С), за пределами которого заметно изменяется (увеличивается или уменьшается).
Точная зависимость скорости реакции от температуры задается уравнением Аррениуса:
k = A × 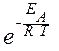 ,
,
где k - константа скорости реакции при температуре Т; A - постоянная, которая зависит только от природы взаимодействующих веществ; R - универсальная газовая постоянная; T - температура по шкале Кельвина (К); e - основание натурального логарифма (2,718); E A - энергия активации.
Уравнение Аррениуса является следствием теории активных соударений. По этой теории, не любое столкновение молекул взаимодействующих веществ приводит к образованию продуктов. Большинство частиц в момент соударения имеет суммарную кинетическую энергию меньше некоторого минимального значения, которое называется энергией активации (Е А). Столкновение частиц с энергией Е < Е А не приводит к их взаимодействию и они разлетаются как упругие мячики после соударения друг с другом. Лишь малая часть молекул исходных веществ имеет суммарный запас энергии Е ³ ЕА. В этом случае соударение будет неупругим (или активным) и в результате его могут появиться новые молекулы (продукты реакции).
Величина энергии активации зависит только от природы реагирующих веществ и наличия в системе какого-либо катализатора.
Катализ.
Допустим, взаимодействие между веществами А и В протекает со скоростью v0 по уравнению:
A + B = AB v0 .
Введем в данную систему некое вещество, которое в дальнейшем будем называть катализатором (К). Катализатор взаимодействует с веществом А со скоростью v1 :
A + K = AK v1 .
Промежуточный продукт (АК) взаимодействует с веществом В со скоростью v2:
AK + B = AB + K v2 .
Итак, в присутствии катализатора процесс протекает более сложным образом:
A 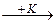 AK
AK 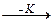 AB v3.
AB v3.
Cкорость такого взаимодействия (v3) равна скорости самой медленной стадии процесса (v3 = v1 или v3 = v2). Если v1 > v0 и v2 > v0, то v3 > v0, другими словами произошло увеличение скорости химической реакции в присутствии катализатора. В этом случае катализатор называют положительным катализатором. Если наоборот, v1 и v2 меньше v0, то катализатор называют отрицательным катализатором или ингибитором.
Катализатор - это вещество, изменяющее скорость реакции (увеличивающее или уменьшающее), но не входящее в состав продуктов взаимодействия. Реакции, протекающие в присутствии катализаторов называются каталитическими, а явление изменения скорости реакции в присутствии катализатора называется катализом.
По сути дела, катализатор изменяет энергию активации данной реакции. Положительный катализатор (часто его называют просто катализатором) уменьшает энергию активации, а отрицательный (ингибитор) - увеличивает.
Действие катализатора носит специфический характер. Так, например, оксид ванадия V2O5 ускоряет только процессы окисления с участием молекул кислорода (О2). Положительные катализаторы и ингибиторы широко используются в промышленности и технике.
Дата добавления: 2015-04-29; просмотров: 1320;
