Метод валентных связей
Метод валентных связей (МВС) описывает образование ковалентных связей в молекулах с позиций квантовой механики. Он базируется на следующих основных положениях:
1. Химическая связь образуется за счет попарного перекрывания валентных атомных орбиталей (АО).
2. В результате перекрывания АО появляется общая для двух атомов электронная пара с антипараллельными (т.е. противоположными по знаку) спинами, которая обеспечивает одну химическую связь.
3. В ходе взаимодействия АО могут подвергаться гибридизации (при этом получаются ГАО - гибридные атомные орбитали).
По сути дела, МВС является более совершенным вариантом теории ковалентной связи. В МВС химическая связь так же может быть образована двумя способами:
1. Обменный механизм
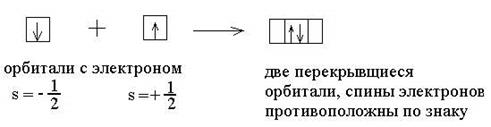
2. Донорно-акцепторный механизм
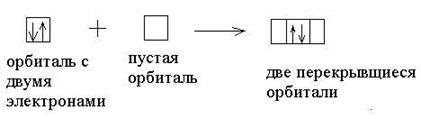
Связи, образованные одними и теми же атомами различными способами абсолютно неотличимы друг от друга. Так, молекула водорода может быть получена как по обменному, так и по донорно-акцепторному механизмам:
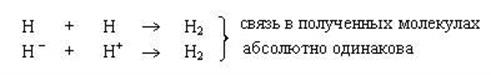
МВС дает ясную и точную трактовку понятия валентности. Валентность- это число АО данного атома, принявших участие в перекрывании с АО других атомов по обменному или донорно-акцепторному механизмам.
Атомы могут образовывать связи как в нормальном (невозбужденном), так и в возбужденном состоянии. Переход атома в возбужденное состояние связан с перескоком валентных электронов с одного валентного подуровня на другой. При этом появляется дополнительное количество неспаренных электронов и увеличиваются валентные возможности атома по обменному механизму.
Пример: атом фосфора в нормальном состоянии имеет электронное строение 1s2 2s2 2p6 3s2 3p3 или [Ne] 3s2 3p3 . Валентные электроны фосфора (3s2 3p3) распределены по валентным орбиталям следующим образом:
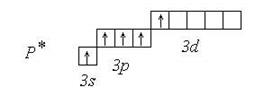
Невозбужденный атом фосфора может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному (за счет пары электронов 3s2). Поэтому такой атом фосфора может иметь валентность или III или IV.
Возбужденный атом фосфора (Р*) может образовать 5 связей по обменному механизму, то есть его валентность равна V. И, действительно, фосфор в своих соединениях проявляет валентность III (PH3 - фосфин), IV (P 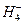 - ион фосфоний), V (H3PO4 - фосфорная кислота). Другие валентности для фосфора нехарактерны.
- ион фосфоний), V (H3PO4 - фосфорная кислота). Другие валентности для фосфора нехарактерны.
Если атомы в ходе химического взаимодействия не подвергаются гибридизации, то описание образования связей с позиций МВС осуществляется следующим образом: а) составляется орбитальная диаграмма образования связей; б) схематически изображается перекрывание орбиталей в пространстве.
Пример: молекула Cl2.
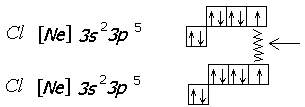
Данная диаграмма показывает, что в молекуле Cl2 существует одна ковалентная связь, образованная по обменному механизму. Графическая формула этой молекулы: Cl - Cl .
Пространственное строение молекулы Cl2 (изображены только 3p - орбитали):
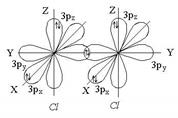
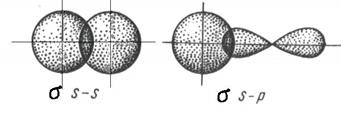
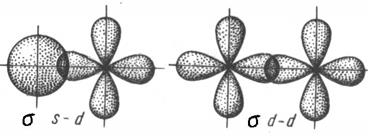
По типу перекрывания орбиталей различаются s - связи, p - связи и d - связи.
s - cвязь образуется при “лобовом” перекрывании орбиталей, т.е. максимум перекрывания АО находится на прямой линии, соединяющей ядра атомов. s - связь самая прочная. Она может образовываться при перекрывании орбиталей любого вида:

В случае p - связи максимумы перекрывания АО находятся в 2-х областях, лежащих на плоскости, проходящей через ядра атомов:
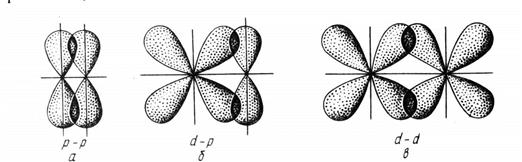
В случае d - связи максимумы перекрывания АО находятся в 4-х областях, лежащих на 2-х взаимно перпендикулярных плоскостях, проходящих через ядра атомов. Связи такого типа могут возникать только при перекрывании d - и f - орбиталей и изучены очень мало.
Дата добавления: 2015-04-29; просмотров: 2057;
