Обратимость химических реакций.
Любая химическая реакция в принципе обратима, то есть может протекать как в прямом направлении (по уравнению - слева направо), так и в обратном (справа налево):
H2(г) + J2(г) 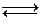 2 HJ(г) .
2 HJ(г) .
Если прямая реакция протекает очень сильно, а обратная - в очень малой степени, то такие реакции называют практически необратимыми и знак обратимости (  ) не ставят:
) не ставят:
C(т) + O2(г) = СO2(г) .
Разложение оксида углерода (IV) на простые вещества - маловероятный процесс в обычных условиях и при нагревании до температур порядка 2000 °С и поэтому процесс можно считать (условно) необратимой реакцией.
Рассмотрим взаимодействие между водородом и азотом, которое является типичным случаем обратимой реакции:
3H2(г) + N2(г)  2 NH3(г) .
2 NH3(г) .
Допустим, в начальный момент времени были смешаны некоторые количества газообразных Н2 и N2. По закону действующих масс, скорость их взаимодействия ( v1) равна:
 v1= k1 [N2] [H2]3 .
v1= k1 [N2] [H2]3 .
Причем, v1 в момент смешивания будет максимальна, а по мере расходования исходных веществ постепенно будет убывать (см. рисунок).
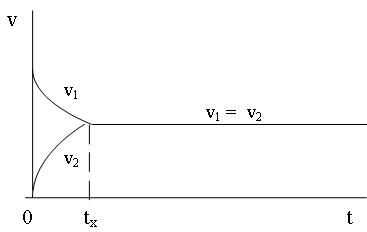
В начальный момент времени скорость обратной реакции (v2) равна нулю, т.к. аммиака в системе нет (концентрация его равна нулю):
v2 = k2 [NH3]2 .
Но по мере протекания реакции v2 начинает возрастать. Через некоторый промежуток времени tx скорости прямой и обратной реакции сравняются. Такое состояние системы называется химическим равновесием. При этом прямой и обратный процессы не прекращаются, хотя видимых изменений в системе нет. В течение 1 секунды из азота и водорода образуется N молекул аммиака, но за это же время N молекул аммиака распадается на азот и водород. Значит, концентрации [H2], [N2] и [NH3] остаются постоянными. Эти концентрации в состоянии равновесия называются равновесными концентрациями:
v1 = k1 [N2]р [H2] 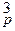 ,
,
v2 = k2 [NH3] 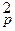 .
.
v1 = v2 (состояние равновесия)
k1 [N2]р [H2] 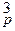 = k2 [NH3]
= k2 [NH3] 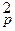 ,
,
k1/ k2 = Kp = .
Отношение констант прямой и обратной реакции называется константой химического равновесия (Кр) .
Константа равновесия определяет соотношение концентраций исходных веществ и продуктов реакции в состоянии химического равновесия. Величина константы равновесия зависит только от природы реагирующих веществ и температуры. Константа равновесия не зависит от концентрации веществ, на нее не влияет катализатор (он изменяет энергию активации прямой и обратной реакции в одинаковой степени, поэтому отношение констант скоростей остается постоянным).
Дата добавления: 2015-04-29; просмотров: 1110;
