Теория гибридизации
Попытки применения МВС в простейшем варианте, изложенном выше для описания химического строения большинства молекул состоящих из 3 и более атомов оказались неудачными. Во многих случаях теория абсолютно не соответствовала экспериментальным данным. Для устранения этого противоречия была разработана теория гибридизации.
Гибридизация - это глубокая перестройка АО, возникающая при переходе атома из нормального в возбужденное состояние. При этом АО превращаются в ГАО (гибридные атомные орбитали). ГАО резко отличаются от исходных АО по энергии, форме и ориентации в пространстве. В то же время ГАО одного атома абсолютно одинаковы по энергии и форме между собой.
Пример: sp3- гибридизация атома углерода:
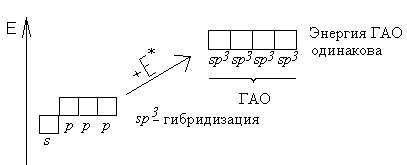
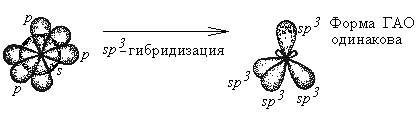
Все ГАО имеют форму ассиметричной гантели (т.е. вытянуты в одном направлении). Гибридизации могут подвергаться только орбитали валентных подуровней. В ходе гибридизации из n АО получаются n ГАО. ГАО участвуют в образовании только s - связей, причем эти связи более прочные, чем аналогичные s - связи с участием негибридных АО.
В настоящее время в различных веществах обнаружено около 20 различных типов гибридизации. Но чаще всего встречаются 6 типов гибридизации:
| Тип гибридизации | Взаимное расположение ГАО в пространстве | Структурные формы |
| sp |

|

|
| sp2 |

|
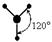
|
| sp3 | 

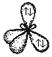
|
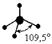
|
| sp3d1 | 
|
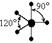
|
| sp3d2 | 
|
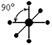
|
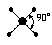
| spd2 | 
| 
|
Наличие гибридизации и ее тип у того или иного атома в молекуле в общем случае предсказать нельзя. Для однозначного решения этой задачи в большинстве случаев нужно знать:
1. Сколько связей между каждой парой атомов (первая связь - всегда s - связь, вторая и третья - p - связи).
2. Чему равны валентные углы (углы между связями) или, по крайней мере, чему равен дипольный момент молекулы (сумма дипольных моментов связей).
Пример 1. Известно, что молекула CСl4 неполярна (½m½ = 0). Углы между связями С - Сl одинаковы и равны 109°28¢. Все связи C - Cl одинаковы по длине и энергии. Все эти данные свидетельствуют в пользу того факта, что углерод в этой молекуле находится в состоянии sp3 - гибридизации.
Поэтому орбитальная диаграмма выглядит следующим образом:
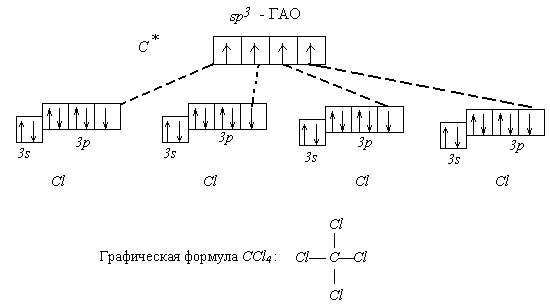
Пространственноестроение CCl4 - атомы Cl образуют правильную фигуру (тетраэдр). Относительно возможной гибридизации атомов хлора ничего сказать нельзя, т.к. исходных данных недостаточно для этого.
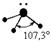
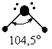
Пример 2. Молекула Н2О полярна ( çm ç ¹ 0 ), угол между связями Н-О равен 105°30¢. Водород не может подвергаться гибридизации, так как у него всего одна валентная орбиталь. Кислород может быть негибридизированным (тогда угол между связями должен быть 90°) или иметь один из 3 типов гибридизации (другие невозможны из-за отсутствия валентных d и f - орбиталей): sp - гибридизация (валентный угол 180°), sp2 - гибридизация (120°), sp3 - гибридизация (109°28¢).
Так как валентный угол в молекуле воды наиболее близок к таковому для случая sp3 - гибридизации, орбитальная диаграмма этой молекулы следующая:
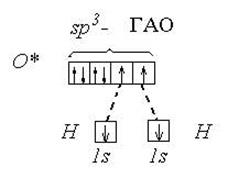
Валентный угол в такой молекуле отличается от стандартного тетраэдрического (109°28¢) за счет того, что ГАО кислорода неравноценны: две из них связывающие (принимают участие в образовании связей О - Н), а две – несвязывающие:
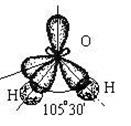
Несвязывающие атомные орбитали кислорода сильно отталкиваются друг от друга и это приводит к тому, что валентный угол в молекуле воды меньше на 5° относительно стандартного для sp3-гибридизации.
Пример 3: Молекула СО2 неполярна ( çm ç = 0). Этого вполне достаточно, чтобы описать строение этой молекулы. Каждая связь С - О является полярной, так как атомы углерода и кислорода сильно отличаются по электроотрицательности. Чтобы молекула в целом была неполярной, необходимо чтобы связи С - О имели валентный угол равный 180°:
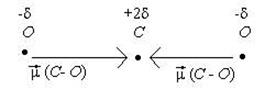
При сложении 2 векторов одинаковых по длине и противополжных по направлению получается ноль. Угол 180° соответствует sp -гибридизации атома углерода. Отсюда следует орбитальная диаграмма:
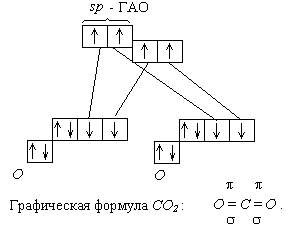
Дата добавления: 2015-04-29; просмотров: 2142;
