Смещение химического равновесия
Химическое равновесие является случаем устойчивого равновесия. Если система находится в состоянии устойчивого равновесия и на нее не оказываются внешние воздействия, она будет находиться в этом состоянии бесконечно долго.
Некоторые воздействия (изменение температуры, изменение концентрации одного из веществ, изменение давления) могут вывести систему из состояния равновесия. Но за счет того, что система находится в состоянии именно устойчивого равновесия, она самопроизвольно возвращается опять в состояние равновесия.
Принцип Ле-Шателье: если на систему, находящуюся в состоянии химического равновесия оказать какое-либо внешнее воздействие, выводящее ее из этого состояния, то в системе усилится тот процесс (прямая или обратная реакция), который возвратит систему в состояние равновесия.
Часто говорят о сдвиге (смещении) равновесия в системе: усиление прямой реакции приводит к смещению равновесия вправо (в сторону продуктов), а усиление обратной реакции смещает равновесие влево (в сторону исходных веществ).
Например, для обратимой реакции:
3H2(г) + N2(г) 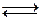 2NH3(г) + Q .
2NH3(г) + Q .
Внешнее воздействие влияет на равновесие следующим образом:
| Внешнее воздействие | Смещение равновесия |
| 1. Увеличение концентрации одного из исходных веществ (Н2 или N2) | 1. Вправо |
| 2. Уменьшение концентрации одного из исходных веществ (Н2 или N2) | 2. Влево |
| 3. Увеличение концентрации продукта | 3. Влево |
| 4. Уменьшение концентрации продукта (NH3) | 4. Вправо |
| 5. Увеличение температуры | 5. Влево (т.к. эндотермической является обратная реакция) |
| 6. Уменьшение температуры | 6. Вправо (т.к. эндотермической является прямая реакция) |
| 7. Увеличение давления | 7. Вправо (т.к. в уравнении данной реакции слева 4 моль газообразных веществ, а справа только 2 моль). |
| 8. Уменьшение давления | 8. Влево (см. пункт 7) |
Любое смещение равновесия для данной системы можно доказать двумя способами: по принципу Ле-Шателье или исходя из понятия о константе равновесия.
Например: произошло увеличение концентрации молекул Н2 (в реакционный сосуд ввели некоторое дополнительное количество газообразного водорода).
1. По принципу Ле-Шателье должна усиливаться та реакция, в ходе которой концентрация Н2 уменьшается, то есть водород расходуется. Это прямая реакция, а значит равновесие смещается вправо.
2. До внешнего воздействия система была равновесной, то есть выполнялось равенство:
Kp = 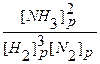
После введения в систему дополнительного количества водорода концентрации всех веществ стали неравновесными, т.к.:
Kp > 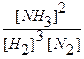
Чтобы система вернулась в состояние равновесия необходимо, чтобы увеличилась концентрация продукта (NH3) или уменьшились концентрации исходных веществ (H2 или N2). Если усилится прямая реакция, то произойдет и то и другое (концентрация NH3 увеличится, а концентрация H2 и N2 уменьшатся). Произойдет смещение равновесия вправо и концентрации веществ опять станут равновесными (но теперь уже будут иметь другие значения).
Дата добавления: 2015-04-29; просмотров: 1232;
