Влияние давления на константу химического равновесия
Когда законы идеальных газов не применимы 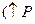 и
и 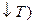 , в равновесии для такой реакции соблюдается соотношение:
, в равновесии для такой реакции соблюдается соотношение:
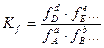 ,
,
где: 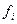 - летучесть исходных веществ и продуктов реакции.
- летучесть исходных веществ и продуктов реакции.
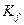 - величина, зависящая только от температуры.
- величина, зависящая только от температуры.
Отношение летучести газа к его давлению называется коэффициентом активности: 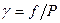
Коэффициент активности является функцией приведенных температур и давления:
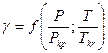
Т.к. 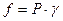 , то
, то 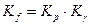 , отсюда следует:
, отсюда следует:
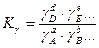 ,
,
Для вычисления константы равновесия при высоком давлении определяют величину 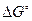 , по которой находят
, по которой находят 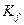 при данной температуре. Затем вычисляют значения коэффициента активности
при данной температуре. Затем вычисляют значения коэффициента активности 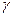 и величину
и величину 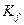 , и из уравнения
, и из уравнения 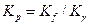 определяют константу равновесия
определяют константу равновесия 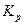 при давлении
при давлении 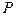 .
.
Исследованиями установлено, что для процессов, осуществляемых при высоких давлениях, константа равновесия уменьшается с 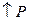 .
.
При низких давлениях летучесть можно приравнять к давлению, т.е. летучесть характеризует отклонение газа от идеального состояния.
Дата добавления: 2015-06-12; просмотров: 1292;
