КОНСТАНТА РАВНОВЕСИЯ ХИМИЧЕСКОЙ РЕАКЦИИ
Наряду с химическим взаимодействием между исходными веществами (прямой реакции) происходит химическое взаимодействие и между продуктами реакции, т.е. обратная реакция.
По мере протекания процесса скорость прямой реакции уменьшается, в то время как скорость обратной реакции увеличивается. При равенстве этих скоростей наступает химическое равновесие.
Т.о., химическим равновесием называется такое состояние обратимого процесса:
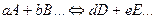
при котором скорость прямой реакции
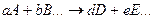
равна скорости обратной реакции
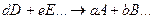
При химическом равновесии отношение произведения молярных концентраций веществ, получающихся при реакции, к произведению молярных концентраций исходных веществ есть постоянная величина для данного химического процесса при заданных условиях протекания реакции.
С момента наступления равновесия в реагирующей системе концентрации и парциальные давления веществ не изменяются. Поэтому для процессов, протекающих при 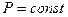 и
и 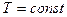 , будут неизменными и отношения
, будут неизменными и отношения
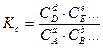 ;
;
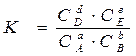 ,
,
где: 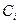 и
и 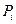 - соответственно равновесные концентрации и парциальные давления.
- соответственно равновесные концентрации и парциальные давления.
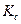 и
и 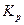 называются константами химического равновесия.
называются константами химического равновесия.
Между 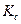 и
и 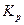 существует взаимосвязь, которая выражается следующим уравнением:
существует взаимосвязь, которая выражается следующим уравнением:
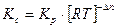 ,
,
где: 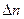 - разность числа молей газообразных веществ:
- разность числа молей газообразных веществ:
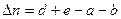
В данном случае справедлив закон Дальтона:
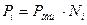 ,
,
где: 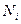 - мольная доля, равная отношению числа молей i-компонента к сумме чисел молей всех компонентов системы.
- мольная доля, равная отношению числа молей i-компонента к сумме чисел молей всех компонентов системы.
При очень большом значении константы равновесия реакция может идти практически до конца, при очень малом – не протекает вообще.
Константа химического равновесия зависит от природы реагентов и от температуры, и в меньшей степени зависит от давления (если давления не высокие), от концентраций, наличия или отсутствия примесей.
Если парциальные давления начальных и конечных продуктов реакции в исходной смеси равны 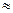 1ат, т.е. они находятся в стандартном состоянии, то изменение стандартной энергии Гиббса выражается зависимостью:
1ат, т.е. они находятся в стандартном состоянии, то изменение стандартной энергии Гиббса выражается зависимостью:
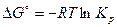 , откуда
, откуда 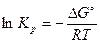
Из этого уравнения следует, что большим отрицательным значениям 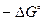 отвечает большее значение
отвечает большее значение 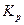 , т.е. преобладание в равновесной смеси продуктов взаимодействия. Наоборот, если
, т.е. преобладание в равновесной смеси продуктов взаимодействия. Наоборот, если 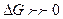 , то в равновесной смеси будут преобладать исходные вещества.
, то в равновесной смеси будут преобладать исходные вещества.
Следовательно, в первом случае можно пренебречь наличием исходных веществ, во втором – наличием продуктов реакции. Если же 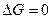 , то
, то 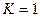 .
.
Объединение двух уравнений:
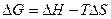 и
и 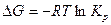
с последующим преобразованием их дает уравнение:
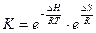 ,
,
которое отражает противоположное влияние на равновесие энтальпийного и энтропийного факторов. Это соотношение позволяет определить возможную глубину реакции, допускаемую в термодинамике.
Дата добавления: 2015-06-12; просмотров: 1395;
