Влияние температуры на химическое равновесие
Влияние изменения условий на положение равновесия определяется по принципу Ле Шателье или по принципу подвижного равновесия.
Если на равновесную систему оказывают какое-либо воздействие, то равновесие смещается в направлении того процесса, протекание которого ослабляет данное воздействие.
В соответствии с принципом Ле Шателье, нагревание вызывает смещение равновесия в сторону того процесса, протекание которого сопровождается поглощением тепла. Или другими словами: повышение температуры вызывает возрастание константы равновесия эндотермического процесса.
Естественно, что понижение температуры приводит к противоположному результату: равновесие смещается в сторону того процесса, протекание которого сопровождается выделением тепла, т.е. охлаждение благоприятствует экзотермическому процессу и вызывает рост константы его равновесия.
Таким образом, для эндотермического процесса нагревание смещает равновесие в сторону продуктов реакции.
Для экзотермического процесса нагревание привело бы к противоположному результату.
Направление смещения равновесия в результате изменения температуры определяется знаком теплового эффекта. Чем больше величина ( 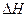 )теплового эффекта, тем значительнее влияние температуры на степень смещения равновесия. Наоборот, если
)теплового эффекта, тем значительнее влияние температуры на степень смещения равновесия. Наоборот, если 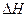 близко к нулю. То температура практически не влияет на равновесие.
близко к нулю. То температура практически не влияет на равновесие.
С помощью уравнения:
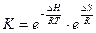
можно количественно определить влияние температуры на равновесие.
Например, равновесие реакции:
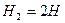
Поскольку реакция эндотермическая, поэтому нагревание вызывает увеличение в равновесной смеси концентрации атомарного водорода, а охлаждение – молекулярного водорода.
Исходное состояние системы:
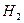 =
= 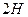
1моль 0моль
Равновесное состояние системы:
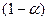 моль 2
моль 2 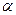 моль
моль
Общее количество реагентов:
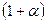 моль
моль
Парциальные давления реагентов в момент равновесия:
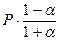
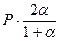
В соответствии с уравнением:
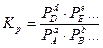
получаем:
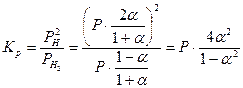 .
.
Дата добавления: 2015-06-12; просмотров: 2863;
