Влияние концентрации на химическое равновесие
В соответствии с принципом Ле Шателье введение в равновесную систему дополнительных количеств какого-либо реагента (имеется в виду исходное вещество или продукты реакции) вызывает сдвиг равновесия в том направлении, при котором концентрация этого вещества уменьшается.
Поэтому избыток исходного вещества вызывает смещение равновесия вправо, увеличивая степень превращения других реагентов. И наоборот, добавление продукта реакции вызывает смещение равновесия влево, т.е. уменьшение степени полноты ее протекания.
Если направление смещения равновесия в химическом процессе определяется избытком какого-либо из реагентов (исходного вещества или продуктов реакции), то степень смещения равновесия при данном количестве реагента определяется величиной стехиометрических коэффициентов.
Например:
Рассмотрим реакцию, протекающую в водном растворе (качественная реакция на ионы 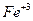 , которая используется при определении
, которая используется при определении 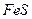 в нефтях и нефтепродуктах):
в нефтях и нефтепродуктах):
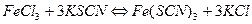
(роданид калия)
Константа равновесия этой реакции будет равна:
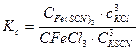
Вид этого выражения показывает не только направление, но и степень смещения равновесия. Изменение концентрации 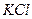 или
или 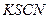 вызовет более значительный сдвиг положения равновесия, чем изменение концентрации
вызовет более значительный сдвиг положения равновесия, чем изменение концентрации 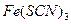 или
или 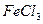 , т.к. стехиометрические коэффициенты в уравнении реакции для
, т.к. стехиометрические коэффициенты в уравнении реакции для 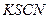 и
и 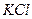 втрое больше, чем для
втрое больше, чем для 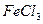 и
и 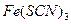 .
.
Во многих случаях смещение равновесия вправо можно осуществить и удалением продуктов процесса из реакционной зоны, связывая их в малодиссоциирующие, труднорастворимые или нелетучие вещества.
Дата добавления: 2015-06-12; просмотров: 1813;
