Химическая кинетика.
Первые систематические исследования скоростей химических реакций были выполнены Н. А. Меншуткиным в 70-х годах прошлого столетия. В 1884 г. Я. Вант-Гофф сформулировал в общей форме кинетические закономерности протекания простых – моно- би- тримолекулярных реакций.
Толчком к дальнейшему развитию химической кинетики послужило установление Аррениусом (1889 г.) роли в химической реакции активных молекул и зависимости скорости простых реакций от температуры. Затем с использованием законов и приемов статистической физики и квантовой механики была создана теория активированного комплекса.
Усилиями различных ученых была установлена важная роль в кинетике сложных реакций промежуточных веществ. Изучение промежуточных веществ было стимулировано открытием обычных и разветвленных цепных реакций.
Было установлено, что промежуточные вещества представляют собой активные частицы – свободные атомы, радикалы, ионы, обладающие высокой реакционной способностью.
Скорость химической реакции в замкнутой системе определяется экспериментально по изменению во времени концентраций исходных, промежуточных веществ или продуктов реакции. Зависимость концентраций этих веществ от времени обычно представляются кривыми, которые называют кинетическими кривыми.
С помощью специальных приемов математической обработки на кинетических кривых получают кинетические параметры реакции – константу скорости, порядок реакции, энергию активации.
Скорость химической реакции зависит от температуры. Зависимость константы реакции от абсолютной температуры устанавливает уравнение Аррениуса:

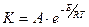 ,
,
где:  и
и 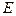 - соответственно предэкспоненциальный множитель и энергия активации реакции.
- соответственно предэкспоненциальный множитель и энергия активации реакции.
Численные значения  и
и 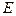 определяют графически соответственно по начальной ординате и углу наклона прямой линии, представляющей опытные данные в координатах
определяют графически соответственно по начальной ординате и углу наклона прямой линии, представляющей опытные данные в координатах 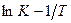 .
.
Порядок реакции по данному веществу – это показатель степени при концентрации этого вещества в кинетическом уравнении.
 …,
…,
где:  - скорость реакции:
- скорость реакции:
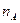 - порядок реакции по веществу А;
- порядок реакции по веществу А;
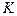 - константа скорости реакции (равна скорости реакции
- константа скорости реакции (равна скорости реакции  при концентрации реагентов равной 1).
при концентрации реагентов равной 1).
Порядок реакции зависит от механизма реакции и может изменяться с температурой и давлением.
Для элементарных реакций – это целочисленная величина, для сложных реакций она может быть дробным, а также отрицательным числом. Порядок реакции, как правило, не превышает 3. Порядок реакции определяется экспериментально, обычно по зависимости скорости реакции от концентрации данного вещества при постоянной концентрации всех остальных веществ. Порядок реакции позволяет судить о механизме реакции.
Энергия активации – это средняя избыточная энергия Е, которой должны обладать реагирующие частицы, чтобы преодолеть потенциальный барьер, разделяющий исходное и конечное состояние системы. Энергию активации обычно определяют по зависимости константы скорости реакции «К» от абсолютной температуры Т. Согласно уравнению Аррениуcа тангенс угла наклона прямой в координатах 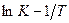 равен
равен 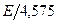 .
.
Различают истинную и эффективную (наблюдаемую) энергию активации в зависимости от того, истинную или эффективную константу скорости реакции определяют в эксперименте.
Для химически насыщенных молекул (молекулярные реакции) значение истинной энергии активации для элементарных реакций составляет 80-240 кДж/моль.
Для радикальных реакций она равна от нескольких до 60 кДж/моль, для ионных реакций и рекомбинации радикалов энергия активации вообще может не требоваться.
Механизм реакций – это совокупность составляющих реакцию элементарных процессов. Различают простые и сложные реакции.
В механизм простой реакции входят:
1. физические процессы передачи энергии, которые лежат в основе активации и деактивации реагирующих частиц;
2. собственно химическое превращение, т.е. перестройка химических связей.
Пример:
Мономолекулярная реакция превращения вещества  в
в 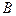 , т.е.
, т.е. 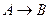 может состоять из следующих элементарных процессов:
может состоять из следующих элементарных процессов:


где:  - активная молекула;
- активная молекула;
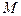 - любая частица в реагирующей системе, которая передает свою кинетическую энергию молекуле
- любая частица в реагирующей системе, которая передает свою кинетическую энергию молекуле  .
.
Сложные реакции состоят из нескольких элементарных стадийобразования и превращения промежуточных веществ, которыми могут быть как молекулы, так и свободные атомы, радикалы, ионы, электроны, возбужденные частицы.
Установление механизма сложных реакций является очень сложной задачей. Эта задача при исследованиях разбивается на два этапа.
1 этап. Определение последовательности элементарных стадий сложной реакции и соотношения их констант скорости;
2 этап. Исследование динамики каждой из элементарных стадий.
При исследовании первого этапа используют как прямые, так и косвенные методы.
Прямое исследование реакций включает идентификацию промежуточных веществ и измерение их концентраций с применением различных физико-химических методов.
При косвенном кинетическом исследовании на основании предполагаемого механизма составляют систему дифференциальных уравнений, включающую уравнения каждой из элементарных стадий. В простых случаях удается получить уравнение для суммарной скорости реакции. Сопоставляя решение этого уравнения с наблюдаемыми на опыте зависимостями скорости реакции от времени судят о правильности (адекватности) предполагаемого механизма.
Описание предполагаемого механизма требует хорошего знания законов строения и реакционной способности органических соединений, законов химической термодинамики и катализа.
Для решения задачи на втором этапе применяют как экспериментальные, так и теоретические методы (квантовые химические расчеты).
Катализ – это изменение скорости или возбуждение химической реакции веществами, которые участвуют в реакции, но не входят в состав конечных продуктов.
Различают положительный катализ – ускорение реакции (катализаторы) и отрицательный катализ – замедление реакции (ингибиторы). Обычно термин катализ относится к ускорению реакции.
Существует гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор и реагенты находятся в одной фазе, при гетерогенном катализе – в разных фазах.
В нефтепереработке в основном используется гетерогенный катализ.
Катализатор не сдвигает химическое равновесие в реагирующих системах, он в равной мере ускоряет и прямую и обратную реакции, но катализатор ускоряет достижение равновесия.
Катализ обусловлен тем, что энергия активации 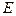 каталитической реакции меньше, чем некаталитической.
каталитической реакции меньше, чем некаталитической.
Каталитическое превращение может осуществляться по стадийному механизму, когда одна некаталитическая реакция типа
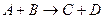
заменяется совокупностью нескольких стадий последовательного взаимодействия реагентов с катализатором с образованием на каждой стадии активированного комплекса.

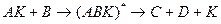
Или по слитному (ассоциативному, синхронному) механизму, включающему одновременное взаимодействие всех реагентов с катализатором и образование одного активированного комплекса

Современная теория катализа считает, что при гомогенном катализе осуществляется новый путь реакции, состоящий из нескольких стадий, в ходе которых образуются и разлагаются неустойчивые промежуточные соединения реагентов с катализатором. Ускорение реакции объясняется тем, что скорость каждой стадии больше, чем скорость некаталитической реакции.
Адсорбционная теория гетерогенного катализа ускорение реакции объясняет деформирующим (разрыхляющим) действием катализатора на химические связи в реагирующих молекулах.
Электронные теории гетерогенного катализа каталитическую активность металлов и полупроводников объясняют наличием электронов проводимости, которые могут принимать участие в окислительно-восстановительных превращениях на поверхности катализатора.
ЛЕКЦИЯ №2
Дата добавления: 2015-06-12; просмотров: 1042;
