Химическая термодинамика
Химическая термодинамика изучает химические реакции и физико-химические процессы с помощью термодинамических методов, а также зависимости термодинамических свойств веществ от их состава, агрегатного состояния и внешних факторов – температуры, давления и др. В узком смысле под химической термодинамикой понимают учение о химическом равновесии, основными задачами которого являются предсказание направления химической реакции, ее выхода и равновесного состава смеси в зависимости от состава исходного сырья, температуры и давления (например, 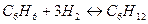 ).
).
Если термодинамический расчет указывает на принципиальную осуществимость рассматриваемого процесса, то подбор условий, обеспечивающих его протекание с достаточной скоростью, осуществляется экспериментальным путем при использовании законов химической кинетики и представлений теории о катализе.
Теоретической базой химической термодинамики являются начала термодинамики и их следствия. Вспомним их.
Первое начало термодинамики – иначе закон сохранения энергии для процессов, сопровождающихся тепловыми явлениями. Согласно первому началу термодинамики система характеризуется функцией состояния – внутренней энергией. В литературе эта функция обычно обозначается буквой «U».Изменение внутренней энергии  может происходить вследствие подвода (или отвода) энергии из окружающей среды в форме теплоты, работы или в результате переноса некоторого количества вещества.
может происходить вследствие подвода (или отвода) энергии из окружающей среды в форме теплоты, работы или в результате переноса некоторого количества вещества.
Для изолированной системы разность полученной системой в каком-либо процессе теплоты 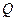 и произведенной ею работы
и произведенной ею работы 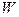 не зависит от условий проведения процесса, а определяется только исходным и конечным состояниями системы.
не зависит от условий проведения процесса, а определяется только исходным и конечным состояниями системы. 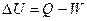 .
.
Первое начало термодинамики лежит в основе большинства уравнений химической термодинамики. Оно позволяет выразить изменения внутренней энергии и энтальпии системы через теплоты протекающих в ней реакций.
Впервые первое начало термодинамики сформулировал Майер в 1842 году. Экспериментально проверил Джоуль в 1845 г.
Второе начало термодинамики устанавливает существование энтропии как функции состояния макроскопической системы и определяет для всех протекающих в природе процессов соотношение между энтропией и теплотой.
Согласно второму началу термодинамики, бесконечно малое изменение энтропии 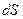 определяется соотношением
определяется соотношением
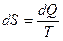 ;
;
где: 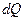 - переданное системе количество тепла;
- переданное системе количество тепла;
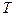 - абсолютная температура.
- абсолютная температура.
Это соотношение справедливо только для обратимых процессов.
Для изолированной системы 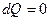 , т.е.
, т.е. 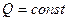 . Отсюда
. Отсюда 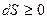 , т.е. в такой системе возможны только процессы сопровождающиеся увеличением энтропии. Состояние термодинамического равновесия отвечает максимуму энтропии системы.
, т.е. в такой системе возможны только процессы сопровождающиеся увеличением энтропии. Состояние термодинамического равновесия отвечает максимуму энтропии системы.
В сочетании с первым началом термодинамики второе начало термодинамики позволяет установить соотношение между энтропией и теплотой также для систем, находящихся в фиксированных внешних условиях.
Третье начало термодинамики – это постулат о предельных значениях энтропии и ее изменениях в процессах, происходящих вблизи абсолютного нуля температуры. Существует несколько формулировок третьего начала термодинамики:
· в любых обратимых процессах при абсолютном нуле температуры энтропия не изменяется. (Нернст)
· энтропия любого термодинамически равновесного вещества при абсолютном нуле температуры равна нулю. (Планк)
· абсолютный нуль температуры не достижим.
Третье начало термодинамики позволяет рассчитывать условия равновесия химических реакций на основании только калориметрических данных (т.е. тепловых).
Кроме трех начал термодинамики существуют и другие функции состояния системы. В химической термодинамике очень широко используется функция, которую называют энергией Гиббса.
Энергия Гиббса устанавливает соотношения между энтропией и энтальпией.
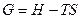
Формулировка:
В закрытой системе при постоянной температуре и давлении все процессы протекают самопроизвольно в направлении убывания энергии Гиббса до достижения ее минимума, которому отвечает состояние термодинамического равновесия системы.
Значения изменения энергии Гиббса при образовании различных веществ из соответствующих простых веществ в стандартных условиях (298 К; 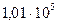 Па) позволяют легко рассчитать стандартное изменение
Па) позволяют легко рассчитать стандартное изменение 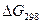 для любой химической реакции, а также функцию от температуры
для любой химической реакции, а также функцию от температуры  . После этого используя соотношение
. После этого используя соотношение 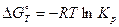 можно рассчитать константу равновесия
можно рассчитать константу равновесия 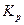 .
.
Энергию Гиббса измеряют в Дж или Дж/моль (Ккал или Ккал/моль).
Энтальпия, которая входит в определение энергии Гиббса, также является термодинамической функцией состояния системы.
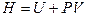 ,
,
где: 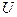 - внутренняя энергия.
- внутренняя энергия.
В изобарном процессе изменение энтальпии равно его тепловому эффекту. Отсюда и название – теплосодержание.
В основном процессы химической технологии, в т.ч. процессы переработки нефти и газа, проводятся при постоянном давлении и теплосодержание очень широко используется в технологических расчетах.
Через разность энтальпий конечных и исходных продуктов выражают тепловые эффекты реакций, в т.ч. теплоты образования, сгорания, энергии связи, а также теплоты фазовых переходов. Стандартные теплосодержания (энтальпии) приводятся в справочниках. Энтальпию измеряют в Дж или Дж/моль (Ккал или Ккал/моль).
Т.о., законы химической термодинамики определяют:
1. принципиальную возможность (или невозможность) протекания реакций в заданных условиях.
2. направление протекания химических реакций.
3. равновесный состав реакционной смеси.
Но законы термодинамики не дают ответа о скорости реакции.
Наука, изучающая скорость реакций и их механизм называется химической кинетикой.
Дата добавления: 2015-06-12; просмотров: 1268;
