АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА. ТВЕРДОЕ ТЕЛО. ХИМИЧЕСКАЯ СВЯЗЬ.
Материя может существовать в газообразном, жидком и твердом состояниях. Эту классификацию можно получить из описания свойств атомов и молекул.
Газы в такой классификации представляют собой самые простые системы и рассматриваются в качестве макроскопических объектов с изотропной пространственной структурой, т.е. не обладают дальним порядком и могут заполнять любое предоставленное им пространство, принимая любую форму. Ближний порядок в газах очень слаб, так что атомы и молекулы движутся почти свободно и хаотично, в соответствии со статистическими закономерностями.
В жидкостях проявляется сильный ближний порядок для атомов и молекул, но отсутствуют дальние взаимодействия, так что они также могут принимать любую форму, но уже могут сопротивляться изменению объема системы, вследствие чего жидкости остаются пространственно изотропными, так что их атомы легко смещаются и двигаются почти хаотически.
Твердые тела относятся к самым устойчивым формированиям, т.к. их атомы и молекулы пространственно объединены в кристаллические решетки и образуют неизотропные системы. Наличие в них ярко выраженного дальнего порядка позволяет твердым телам оказывать сильное сопротивление изменению объема и формы.
Каждый из нас лепил в детстве из пластилина, вырезал бумажные фигурки и склеивал их между собой, пришивал пуговицу… Так или иначе, все мы понимаем, что объекты окружающего нас мира удерживаются вместе не “абы как”, а с помощью каких-то дополнительных сил. Эти силы заметно различаются в зависимости от своей природы: в одном случае это нитка, соединяющая вместе кусочки ткани, в другом – всемирное тяготение, в третьем – клей, глина и т.п. В мире атомов и молекул роль такого универсального “клея”, связывающего их между собой, выполняет химическая связь. Природа химической связи объясняется силой электрического притяжения между
отрицательными электронами и положительными ядрами. Подобно тому, как разные виды клея различаются прочностью, сила химической связи также неодинакова для разных веществ. Об этом свидетельствует наш повседневный опыт: одни вещества легко разрушаются при малейшем воздействии (например, соль растворяется воде), так как связи между их атомами очень слабы. Атомы других веществ связаны сильнее, но и они поддаются деформации (например, металлы, которые можно гнуть и ковать); третьи - же вещества (алмаз) настолько прочны, что им нипочем ни сверхвысокие температуры, ни давление. Соль, металл и алмаз являются яркими представителями трех наиболее характерных типов химической связи – ионной, металлической и ковалентной. Атомы вступают в химические связи с единственной целью: приобрести устойчивую электронную конфигурацию (полностью заполнить свою внешнюю электронную оболочку). Впервые эту гипотезу выдвинули в 1916 г. ученые Коссель и Льюис, а впоследствии она была доказана и экспериментально.
Ранее говорилось о том, что атомы так называемых “благородных газов” (гелия, неона, аргона и др.) упорно избегают химических связей. Такая “неприступность” этих элементов обусловлена тем, что каждый из них сам по себе имеет устойчивую электронную конфигурацию. Конфигурация гелия – 1s2, а остальных – Ns2Np6, где N – номер соответствующего химического ряда. В отличие от инертных газов, остальные атомы имеют неустойчивую электронную конфигурацию и охотно вступают в химические связи с другими элементами. Способность образовывать связи называется валентностью.
Ионная связь.Ионная связь представляет собой электрическое притяжение между противоположно заряженными ионами (частицами, несущими электрический заряд). Согласно гипотезам Планка и Бора, энергия каждого электрона в атоме квантована и принимает лишь определенные значения, соответствующие конкретным энергетическим уровням (орбитам). Электроны могут переходить с одного уровня на другой, поглощая или излучая фотоны. Поглотив фотон, электрон переходит на более высокую орбиту, а сила, связывающая его с ядром, уменьшается. Если электрону удается полностью “освободиться” от сил притяжения ядра и покинуть атом, то происходит ионизация
атома. Атом превращается в положительный ион, именуемый катионом и обозначаемый знаком “плюс”.Na+, Аg+ _ катионы натрия и серебра, соответственно. Если же атом, наоборот, принимает в себя дополнительные электроны, то их избыток превращает его в отрицательный ион – анион, который изображается с “минусом”, например: Cl-, O- - -анионы хлора и кислорода.
Напомним, что химическая связь объясняется стремлением атомов приобрести устойчивую электронную конфигурацию, подобную конфигурации “ближайшего” к ним инертного газа. Рассмотрим некоторую последовательность элементов в таблице Менделеева, среди которых имеется неон (1s12s22p6). В скобках рядом с символом элемента указано число электронов в K*, L* и М_оболочках. F(2.7); Ne(2.8); Na (2.8.1) Атом натрия может приобрести устойчивую электронную конфигурацию неона, избавившись от одного электрона. Образовавшаяся частица – положительно заряженный ион натрия. У фтора на один электрон меньше, чем у неона. Следова_
тельно, если фтор присоединит один электрон (например, от атома натрия), он приобретает заполненную внешнюю оболочку из восьми электронов: Между полученными частицами – анионом фтора и катионом натрия – будет действовать сила электростатического притяжения, связывающая их между собой. Это и называется ионной химической связью.
Одно из свойств ионных соединений – способность образовывать кристаллическую решетку, в узлах которой расположены положительные и отрицательные ионы (рис.23). Типичный представитель вещества с ионной связью – всем известная поваренная соль. Ее формула – NaCl. Большинство ионных соединений легко разрушаются под внешним воздействием или в химических реакциях (рис. 178, 179). На рисунке 178 показано, что происходит, если на ионный кристалл действует деформирующая сила. Небольшие сдвиги в кристаллической решетке сближают одинаково заряженные ионы. При этом силы отталкивания между одноименными зарядами создают трещины в кристалле.
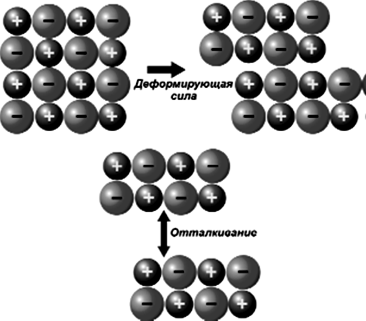
Рис.178 Схема поведения кристаллической решетки NaCl под действием деформирующей силы
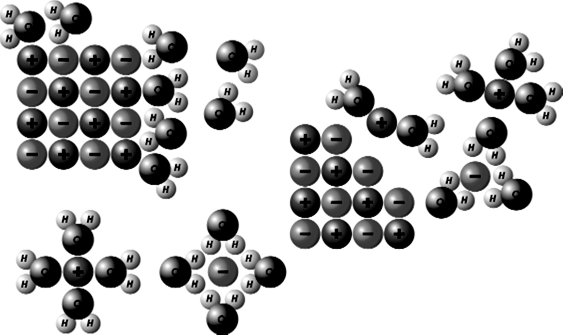
Рис.179. Иллюстрация процесса растворения поваренной соли вводе
Ковалентная связь.Ионная связь – не единственный тип химической связи. Существуют соединения типа H2, O2, N2, Cl2 и т.д, для которых характерна так называемая ковалентная связь. Ковалентная связь также называется гомеополярной или обменной. В молекуле хлора Cl2 (3s23p5) мы встречаемся с так называемой ковалентной связью между атомами. В такой связи каждый из двух атомов делится с другим одним из своих внешних электронов (рис. 180). При этом оба приобретают восьмой электрон в свою внешнюю оболочку и обретают устойчивую конфигурацию. Каждую ковалентную связь удобно схематически представить палочкой (С-С) или в виде точки и крестика.

Рис. 180 Схема ковалентной связи
Каждая точка или крестик изображают электрон в валентной оболочке атома. Электроны, образующие общую пару, называются валентными. Образуя ковалентную связь, они занимают одну и ту же орбиталь, а их спины, согласно принципу Паули, направлены в противоположные стороны. Таким образом, орбитали атомов при ковалентной связи перекрываются между собой.
Для того чтобы орбитали перекрывались, расстояние между атомами должно быть очень маленьким. Этому препятствуют силы отталкивания между их ядрами. Но ковалентная связь достаточно сильна, чтобы удержать атомы в таком положении. Благодаря этому нелегко оторвать атомы с общей орбиталью друг от друга. Ковалентная связь наиболее характерна для молекул, состоящих из одинаковых атомов (например, H2 или Cl2), либо каркасных структур (алмаз). Двойная, и, тем более, тройная ковалентные связи прочнее обычной. Ионная и ковалентная связи являются двумя предельными случаями множества реально существующих химических связей, которые в действительности имеют промежуточный характер. Однако можно утверждать, что некоторые соединения являются преимущественно ионными, а некоторые – преимущественно ковалентными.
_
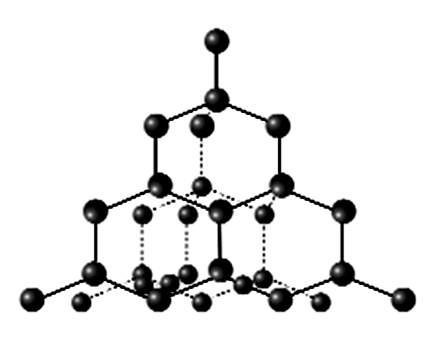
Рис.181 Структура алмаза
Именно большая энергия ковалентной связи объясняет феноменальную прочность алмаза, в котором каждый атом углерода ковалентно связан с четырьмя другими, объединяющие свои электроны для совместного достижения электронной устойчивости (рис.181). В подобном контексте неудивительно, что ковалентная связь гораздо стабильнее, чем ионная, а также обладает гораздо большей энергией (прочностью)!
Характерной особенностью обменной связи является насыщаемость. Насыщаемость выражает тот факт, что каждый атом может образовывать обменную связь лишь с определенным числом своих соседей. Так, каждый атом водорода может устанавливать лишь с одним из своих соседей. Пара электронов, образующих эту связь, обладает антипараллельными спинами и занимает одну квантовую ячейку. Обмен с третьим атомом вызывает уже не притяжение , а отталкивание.
Металлическая связь. Металлы – очень распространенный материал современной промышленности. Большая часть машин, станков, инструментов и транспортных средств изготовлена из металла. Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью. Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов (рис.6).
Показана траектория одного из свободно движущихся электронов Электроны в металлах делокализованы, то есть не принадлежат какому-либо конкретному атому. Как получается такое уникальное электронное “море”? Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали. Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь. Когда атомов много, возникает огромное число трехмерных молекулярных орбиталей, простирающихся во всех направлениях. Вследствие многократного перекрывания орбиталей валентные электроны каждого атома испытывают влияние многих атомов. Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов (рис. 7).
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью. Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
Ван-дер-ваальсовы силы. Наиболее общим видом связи, возникающим между любыми атомами и молекулами, являются силы Ван-дер-Ваальса. Впервые эти силы были введены для объяснения отступления реальных газов от уравнения состояния идеальных газов.
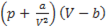 = RT. (13-6)
= RT. (13-6)
Эти силы определяют поправку а/V2.Поправка b учитывает действие сил отталкивания.
Замечательным свойством сил Ван-дер-Ваальса является то, что они возникают между электрически нейтральными системами. При взаимодействии инертных газов они являются единственными силами, делающими возможным существование жидкого и твердого состояния этих веществ.
В 1873 году этот человек выдвинул предположение о существовании сил межмолекулярного притяжения, подобных тем, что существуют в связях между атомами. В дальнейшем гипотеза подтвердилась – были открыты различные типы межмолекулярного взаимодействия, где наиболее распространено так называемое диполь-дипольное притяжение (рис. 182).
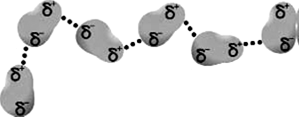
Рис.182 Схема диполь-дипольного притяжения
Некоторые молекулы (преимущественно с ковалентными связями) обладают так называемым дипольным моментом, т.е. является полярными. Между ними возникает электростатическое взаимодействие, стремящиеся расположить молекулы в строгом порядке, т.к. при таком расположении энергия системы минимальна.
Правильная ориентация нарушается тепловым движением. Поэтому энергия системы, определяемая ориентацией молекул сильно зависит от температуры. Рассмотренный вид взаимодействия полярных молекул, зависящий от их ориентации называется ориентационным.
Так например для молекул воды общая энергия взаимодействия складывается из ориентационного эффекта (77%), индукционного эффекта (4%) и дисперсионного эффекта (19%), для хлористого водорода (15%, 4%, 81%) соответственно.
Кроме того, у молекул обладающих высокой поляризуемостью, может возникать индуциорованный электрический момент. Такие молекулы притягиваются друг к другу, а возникающее взаимодействие называют индукционным. Энергия индукционного взаимодействия не зависит от температуры. Его суть в том, что в одной части молекулы “скапливается” больше электронов, чем в другой. Это приводит к возникновению разности потенциалов на ее концах. Сила притяжения между различными зарядами связывает молекулы между собой, как показано на рисунке.
В настоящий момент термин “Ван_дер_ваальсовы силы” распространяется на все слабые межмолекулярные силы, кроме водородной связи.
Сопоставление различных видов связи. Наиболее универсальной связью является связь Ван-дер-Ваальса. Она возникает во всех без исключения случаев. Вместе с этим это наиболее слабая связь, ее энергия мала и соатавляет1-10 103 Дж/моль. В чистом виде они проявляются при взаимодействии нейтральных атомов и молекул, имеющих заполненные электронные оболочки. В частности, эти силы обуславливают существование жидкого и твердого состояний инертных газов, водорода, кислорода, азота. Вследствие того, что энергия Ван-дер-Ваальсовской связи низка, все структуры, обусловленные этой связью, малоустойчивы, легко летучи и имеют низкие точки плавления.
Ионная связь является типичной химической связью, широко распространенной среди неорганических соединений. К ним относятся соединения металлов с галогенами ( NaCl, KCl, NaF, KBr и др.), окислы металлов, сульфиды, карбиды, селениды, нитриды и др. Энергия ионной связи значительно выше энергии Ван-дер-Ваальса и колеблется от 6 105Дж /моль для KCl до 1 107Дж /моль для окиси алюминия (Al2O3)и хрома (Cr).
Ковалентная связь имеет исключительно широкое распространение в органических соединениях, встречается также в некоторых металлах и во многих интерметаллических соединениях. Эта связь обуславливает образование кристаллов типа алмаза, германия. Энергия ковалентной связи порядка 105 Дж /моль.
Наконец, металлическая связь, возникающая в результате обобществления валентных электронов, характерна для типичных металлов и многих интерметаллических соединений. Энергия этой связи по порядку величины сравнима с энергий ковалентной связи
В заключение следует подчеркнуть, что в реальных твердых телах каждая из рассмотренных связей в чистом виде почти никогда не встречается. Практически всегда имеет место наложение двух и более типов связей. Причем, одна из них, как правило, имеет превалирующее значение, определяя структуру и свойства того или иного твердого тела.
Дата добавления: 2015-06-17; просмотров: 4565;
