Теплоемкость. Уравнение Майера
Удельная теплоемкость веществавеличина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
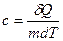
Единица удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг•К)).
Молярная теплоемкость—величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
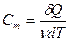 (9-17)
(9-17)
где v = m/M — количество вещества, выражающее число молей.
Единица молярной теплоемкости — джоуль на моль-кельвин (Дж/(моль•К)).
Удельная теплоемкость с связана с молярной Сm соотношением
Ст = сМ, (9-18)
где М — молярная масса вещества.
Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным.
Запишем выражение первого начала термодинамики для 1 моля газа с:
CmdT=dUm + pdVm. (9-19)
Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии:
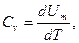 (9-20)
(9-20)
т. е. молярная теплоемкость газа при постоянном объеме Сv равна изменению внутренней энергии 1 моля газа при повышении его температуры на 1 К. Так как
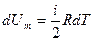 ,
,
то
Cv = iR/2. (9-21)
Если газ нагревается при постоянном давлении, то выражение (9-21) можно записать в виде
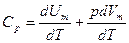 .
.
Учитывая, что dUm/dT не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от р, ни от V, а определяется лишь температурой Т) и всегда равна Сv, продифференцировав уравнение Клапейрона — Менделеева pVm=RT по T(p=const), получим
Cp = Cv + R. (9-22) Выражение (9-22) называется уравнением Майера;оно показывает, что Ср всегда больше Сv на величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа. Использовав (9-21) выражение (9-22) можно записать в виде
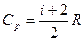
При рассмотрении термодинамических процессов важно знать характерное
для каждого газа отношение Ср к Cv:
g=Cp/Cv=(i+2)/i.
Дата добавления: 2015-04-15; просмотров: 2722;
