ПАТОФИЗИОЛОГИЯ СЕРДЕЧНО-СОСУДИСТОЙ СИСТЕМЫ 3 страница
скольку механизмы адаптации сердечно-сосуди- Различают первичную легочную гипертен-
| Часть III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ |
стой системы могут при этом оказаться несосто- зию' кот°Рая развивается при заболеваниях

|
кардиоваскулярной системы (артериит, митральный стеноз), вызывающих рост сосудистого сопротивления в малом круге, и вторичную легочную гипертензию,которая связана с уменьшением емкости сосудистого русла малого круга кровообращения и наблюдается при тромбоэмболии легочной артерии, заболеваниях легких, резекции легочной ткани, пневмотораксе и т.п.
Примером первичной легочной гипертензии может служить повышение АД в сосудах малого круга при митральном стенозе и дефектах перегородок сердца. Основным звеном патогенеза ЛГ при митральном стенозе является нарушение тока крови из левого предсердия в левый желудочек, что приводит к застою крови в системе легочных вен с последующим повышением артериального давления в артериях малого круга кровообращения согласно рефлексу Китаева (см. ниже). Артериальная Л Г при дефекте межпред -сердной или межжелудочковой перегородки связана с шунтированием крови слева направо и гиперволемией малого круга кровообращения.
В случае вторичной гипертензии, которая наиболее часто развивается при бронхолегочных заболеваниях, повышение давления в артериях малого круга обусловлено уменьшением объема кровяного русла у пациентов с пневмосклерозом и эмфиземой легких. Иногда артериальная легочная гипертензия возникает при острых легочных заболеваниях, например при тяжелом, затянувшемся приступе бронхиальной астмы.
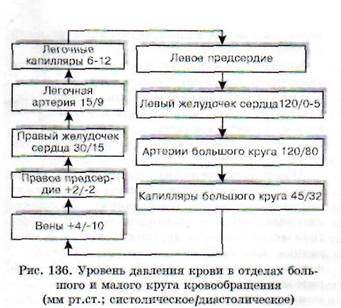
При хронических заболеваниях легких, митральном стенозе и некоторых других заболеваниях давление в легочной артерии нередко ока-
зывается повышенным в 4-6 и даже в 9 раз по сравнению с нормой (рис. 136).
Выраженность гипертензии малого круга зависит от действия двух факторов, первым из которых является механическое препятствие кровотоку, например стеноз митрального клапана, сдавление или окклюзия артериол, а вторым - рефлекторное сужение резистивных сосудов малого круга. Устранение митрального порока с помощью методов реконструктивной кардиохирургии во многих случаях сравнительно быстро приводит к обратному развитию легочной гипертензии. При этом у ряда больных давление в truncus pulmonalis снижается в течение нескольких месяцев после операции с 120-125 до 20-25 мм рт.ст.
Легочная гипертензия приводит к перегрузке повышенным давлением правых отделов сердца с развитием «легочного сердца»(см. разд. 14.3.3).
14.2.4. Сосудистая недостаточность
Классификация гипотонии.Выделяют две группы гипотонии: острую сосудистую недостаточность и хроническую недостаточность тонуса сосудов.
Острая сосудистая недостаточность - это патологическое состояние, основным звеном которого является уменьшение объема циркулирующей крови (ОЦК), приводящеек снижению артериального и венозного давления.Проявлениями этого процесса служат шок, коллапс и обморок (см. гл. 3).
Коллапс- вид острой сосудистой недостаточности, характеризующийся резким понижением артериального и венозного давления и снижением массы циркулирующей крови в сосудистой системе. По этиологии различают следующие виды коллапса:
1.Токсико-инфекционный. Развивается при кишечных инфекциях (дизентерия, сальмонеллез и др.), возбудители которых выделяют эндотоксин, высвобождающийся при гибели микробных тел. При интенсивной антибактериальной терапии может возникнуть одномоментная гибель огромного количества микробов. Высвобождающиеся при этом большие дозы эндотоксина вызывают поражение нервно-мышечного аппарата стенки сосудов с последующей их атонией, что и приводит в конечном итоге к состоянию коллапса.
2. Постгеморрагический. Возникает при острой массивной кровопотере и связан с быстрым уменьшением объема циркулирующей крови и снижением тонуса сосудов.
3. Панкреатический. Может наступить при тяжелой травме живота, сопровождающейся размозжением ткани поджелудочной железы и поступлением в кровь панкреатического сока. Установлено, что трипсин, действуя на гладкую мускулатуру сосудистой стенки, вызывает резкое снижение ее тонуса, что приводит к развитию коллапса.
4. Аноксический. Возникает при быстром снижении парциального давления кислорода во вдыхаемом воздухе. Развивающаяся в этом случае гипоксия вызывает снижение тонуса гладкой мускулатуры сосудистой стенки, что приводит, в свою очередь, к резкому расширению сосудов.
5. Ортостатический. Может возникнуть у больных после длительного (многодневного) постельного режима при резком переходе из горизонтального положения в вертикальное.
Патогенез различных видов коллапса во многом идентичен. В механизме развития этого вида острой сосудистой недостаточности важную роль играет снижение тонуса емкостных сосудов (преимущественно мелких вен), в которых обычно сосредоточена основная масса (75-80%) крови. Такая ситуация может возникнуть вследствие прямого действия различных токсинов на гладкую мускулатуру сосудов или явиться результатом снижения тонической активности симпато-адреналовой системы в сочетании с ваготонией. Депонированная кровь не участвует в циркуляции, что приводит к снижению ОЦК. Итогом этих изменений является уменьшение венозного притока крови к сердцу и вторичное снижение сердечного выброса, в результате чего патологический процесс усугубляется. В дальнейшем при прогрессировании сосудистой недостаточности развивается гипоксия тканей, нарушаются окислительно-восстановительные процессы и возникает ацидоз. Сознание может быть сохранено.
Обморок- острая сосудистая недостаточность, проявляющаяся кратковременной потерей сознания. Возникает даже у абсолютно здоровых людей при эмоциональном возбуждении (страх, боль и пр.), когда имеет место остро возникающее повышение тонуса блуждающих нервов, а также при недостаточности барорецептивного реф-
лекса, обеспечивающего адаптивные реакции системы кровообращения.
Хроническая сосудистая недостаточностьклассифицируется следующим образом:
1) физиологическая гипотония,которая рассматривается как вариант конституциональной нормы, может развиваться у спортсменов ив процессе акклиматизации к условиям высокогорья;
2) патологическая гипотония.К этой группе относятся: а) первичная гипотония, являющаяся самостоятельным заболеванием (нейроцирку-ляторная дистония гипотонического типа, гипотоническая болезнь и другие синонимы); б) вторичная, или симптоматическая, гипотония, которая развивается при заболеваниях пищеварительной системы, длительном голодании, анемиях, гипофункции коры надпочечников и др.
14.3. ПАТОФИЗИОЛОГИЯ СЕРДЕЧНОЙ ДЕЯТЕЛЬНОСТИ
14.3.1. Некоронарогенная патология сердца
Некоронарогенная патология сердечной мышцы неревматической этиологии
Миокардиодистрофии (МКД) - это группа некоронарогенных заболеваний миокарда, возникающих под влиянием экстракардиальных факторов, основными проявлениями которых служат нарушения метаболизма и сократительной функции сердечной мышцы.Понятие МКД было введено в клиническую практику в 1936 г. академиком Г.Ф. Лангом. В качестве причин МКД рассматриваются анемия, недостаточное питание, авитаминоз, поражения печени и почек, нарушения отдельных видов обмена веществ, заболевания эндокринной системы, системные заболевания, интоксикации, физическое перенапряжение, инфекции.
С помощью методов цитохимии и электронной микроскопии в зонах дистрофии сердечной мышцы были выявлены следующие ультраструктурные изменения: увеличение ядер мио-цитов, набухание митохондрий, разрушение их внутренней мембраны, повышение содержания липидов и неэстерифицированных жирных кислот в этих органеллах. Изменения, возникающие в сердечной мышце при этой патологии, не
 являются специфичными и могут подвергаться обратному развитию.
являются специфичными и могут подвергаться обратному развитию.
В развитии МКД выделяют три стадии. / стадия - стадия адаптивной гиперфункции миокарда. Для нее характерен гиперкинетический вариант кровообращения, возникающий вследствие повышения тонуса симпатического и подавления парасимпатического звеньев вегетативной нервной системы. Во II стадии формируются обменно-структурные изменения, приводящие к нарушению функции сердца и появлению клинических признаков недостаточности кровообращения. В III стадии развиваются тяжелые нарушения обмена веществ, структуры и функции сердечной мышцы, проявляющиеся стойкой недостаточностью кровообращения.
Миокардиты(неревматической этиологии) -это воспалительные поражения сердечной мышцы, возникающие вследствие прямого или опосредованного аллергическими реакциями повреждающего действия инфекционных или неинфекционных агентов.Миокардиты развиваются при бактериальных, риккетсиозных, спи-рохетозных, грибковых, вирусных и других инфекциях. К неинфекционным факторам, вызывающим миокардиты, относят некоторые лекарственные препараты - антибиотики и сульфаниламиды, лечебные сыворотки и вакцины.
Особое место среди различных видов воспалительных поражений миокарда занимает идио-патический миокардит Абрамова - Финдлена.Данная форма заболевания характеризуется тяжелым течением с развитием кардиомегалии и выраженной сердечной недостаточности. Причина возникновения этого заболевания невыясне-на. Обсуждается возможная роль вирусной инфекции и аллергических реакций, возникающих как после перенесенной инфекции, так ипосле приема лекарственных препаратов. Прогноз при идиопатическом миокардите неблагоприятен. Больные погибают быстро, в сроки от 2-3 мес до года. Причиной смерти обычно бывают нарушения сердечного ритма или сердечная недостаточность.
Основные проявления МКД и миокардитов, несмотря на их различную этиологию, имеют много общего и определяются выраженностью структурно-функциональных изменений сердца. Обе группы заболеваний характеризуются кардиалгией, симптомами сердечной недостаточности (тахикардия, одышка, акроцианоз, отеки), а также нарушениями сердечного ритма и прово-
димости. При миокардитах, поскольку это воспалительный процесс, выявляются лейкоцитоз, эозинофилия, увеличение СОЭ, а при МКД подобные изменения не обнаруживаются.
Кардиомиопатии.Термин «кардиомиопатия» введен W. Brigden в 1957 г. для обозначения некоронарогенных заболеваний миокарда неизвестной этиологии. В 1968 г. рабочая группа ВОЗ определила кардиомиопатии как заболевания, характеризующиеся кардиомегалией и недостаточностью кровообращения.Кардиомиопатии подразделяются на дилатационные, гипертрофические и рестриктивные.
Дилатационная кардиомиопатия (ДКМП) характеризуется значительным увеличением всех камер сердца и нарушением его систолической функции.Причина данного заболевания остается невыясненной. В настоящее время накапливается все больше данных о том, что дилатационная кардиомиопатия является наследственно-детерминированным заболеванием. Так, ретроспективный анализ историй болезней 169 пациентов с ДКМП, проведенный в США, позволил установить положительный семейный анамнез в 7% случаев. Кроме того, были описаны случаи аутосомно-доминантного и аутосом-но-рецессивного наследования.
При патологоанатомическом исследовании сердца выявляется значительная дилатация полостей. Масса сердца намного увеличена по сравнению с нормальной и может достигать 800-1000 г. Достаточно часто обнаруживаются пристеночные тромбы, участки крупноочагового фиброза миокарда. При микроскопическом исследовании определяются беспорядочная гипертрофия мышечных волокон, нарушение целостности мио-кардиоцитов, клеточный отек, интерстициаль-ный фиброз, иногда незначительное количество клеточных инфильтратов без признаков воспалительного поражения кардиомиоцитов.
Гемодинамические изменения при ДКМП связаны со значительной дилатацией полостей сердца и снижением фракции выброса. Неполное опорожнение левого желудочка приводит к повышению конечного диастолического давления. Постепенно формируется относительная митральная недостаточность вследствие растяжения фиброзного кольца атриовентрикулярного клапана. Повышение давления в полости левого предсердия приводит к развитию ретроградной или венозной легочной гипертензии и значительному увеличению нагрузки на правый желудочек и
правое предсердие. Единственно возможное радикальное лечение ДКМП заключается в проведении трансплантации сердца. Симптоматическая терапия направлена на лечение сердечной недостаточности.
Гипертрофическая кардиомиопатия (ГКМП) характеризуется выраженной гипертрофией миокарда с преимущественным нарушением его диастолической функции.ГКМП относится кгенетически обусловленным заболеваниям с аутосомно-доминантным характером наследования и высокой степенью пенетрантности. Течение заболевания может напоминать клапанные пороки сердца, гипертрофию миокарда при АГ или ишемической болезни сердца. Часто истинный диагноз устанавливается только на секции, когда выявляются асимметричная гипертрофия межжелудочковой перегородки и уменьшение полости левого желудочка.
Патогенез гемодинамических изменений при ГКМП обусловлен нарушениями диастолической функции левого желудочка, движения стенок которого становятся некоординированными и неравномерными. Отмечается повышение конечного диастолического давления в полости левого желудочка. В связи с уменьшением объема левого желудочка происходит уменьшение ударного объема сердца. Многие пациенты с ГКМП отмечают боли в области сердца, напоминающие таковые при стенокардии, которые связаны с нарушением диастолического расслабления желудочков. Нарушение процесса релаксации миокарда приводит к сдавлению коронарных сосудов, а значит, к нарушению доставки кислорода и питательных веществ к кардиомиоцитам, и возникает приступ стенокардии. Гипертрофия миокарда в сочетании с гипоксией сердечной мышцы становится причиной электрофизиологической гетерогенности сердца и создает условия для возникновения аритмий. Именно поэтому у пациентов с ГКМП чаще, чем при других видах кардиомиопатии, наступает фибрилляция и внезапная смерть.
Рестриктивная кардиомиопатия (РКМП)объединяет два заболевания, которые ранее описывались самостоятельно: эндомиокардиальный фиброз и фибропластический париетальный эндокардит Леффлера. Основным звеном патогенеза нарушений гемодинамики при рестриктив-ной кардиомиопатии, как и при ГКМП, является нарушение диастолической функции миокар-
да. Однако при ГКМП это происходит в результате перегрузки кардиомиоцитов ионами кальция, а при РКМП связано с утолщением эндокарда и фиброзным перерождением миокарда. Нарушение процессов релаксации миокарда при РКМП развивается не сразу, а возникает только через два года от начала заболевания, когда, собственно, и формируется фиброз миокарда. На протяжении первых двух лет течение заболевания напоминает миокардит, которому сопутствует эозинофилия. Дегрануляция эозинофилов оказывает токсическое воздействие на эндокард и миокард, обусловливая развитие воспалительных, некротических и фиброзных изменений. Для РКМП характерны образование тромбов в полостях желудочков и поражение митрального клапана в виде прорастания створок фиброзной тканью с последующей кальцификацией.
Патогенетически обоснованное лечение РКМП должно быть направлено на борьбу с сердечной недостаточностью. Хирургическое лечение заключается в иссечении плотной фиброзной ткани и протезировании клапанов по показаниям.
Стрессорная кардиомиопатия- особая форма поражения миокарда. Характеризуется диффузными изменениями, которые возникают после длительного, многочасового экстремального воздействия на организм. В 1974 г. шведский физиолог Johansson для обозначения стрессор-ного повреждения сердца предложил использовать термин «стрессорная кардиомиопатия».Это заболевание морфологически характеризуется появлением дистрофических изменений в клетках миокарда вплоть до некроза отдельных кардиомиоцитов. В начале 70-х годов американским физиологом Бернардом Лауном было установлено, что стрессорная кардиомиопатия сопровождается снижением электрической стабильности сердца. Возникающая в результате стресса электрическая нестабильность сердца (ЭНС) способствует возникновению тяжелых желудочковых аритмий, которые могут закончиться внезапной сердечной смертью (Б. Лаун). На вскрытии у таких пациентов при макроскопическом исследовании сердца очень часто не удается идентифицировать никаких патоморфологических изменений. Причиной стрессорной ЭНС является гиперактивация симпатоадреналовой системы. Патогенез стрессорного повреждения сердца очень сходен с патогенезом его ишемическо-го повреждения.
Инфекционный эндокардит - заболевание, возникающее в результате инфекционного поражения эндокарда.Термин «инфекционный эндокардит» применяется с 1966 г. вместо ранее употреблявшихся терминов «бактериальный» и «затяжной септический эндокардит».
Основными возбудителями заболевания считаются зеленящий стрептококк и золотистый стафилококк. На долю этих микроорганизмов приходится около 80% случаев инфекционного эндокардита. Всего выявлено 119 микроорганизмов, способных привести к развитию этого заболевания, которое начинается с сепсиса. При этом происходит бактериальное поражение клапанов сердца, чаще аортального и реже - митрального, трикуспидального и клапана легочной артерии. После внедрения микроорганизмов в ткань эндокарда происходит дополнительное отложение тромбоцитов и фибрина в этой зоне, что в определенной мере ограничивает контакт возбудителя свнутренней средой организма.
Формирование локальных очагов инфекции считается пусковым механизмом ряда патогенетически значимых процессов в организме, для которых характерны: 1) постоянное поступление инфекционного агента в кровеносное русло сразвитием эпизодов бактериемии, вирусемии, проявляющееся усталостью, снижением массы тела, потерей аппетита, лихорадкой, развитием анемии, спленомегалией; 2) местное развитие микробных вегетации, вызывающее нарушение функции сердца, абсцессы фиброзного клапанного кольца, перикардиты, аневризмы синуса Вальсальвы, перфорацию клапана; 3) отрыв фрагментов микробных вегетации, попадание их в системный кровоток с развитием бактериальных эмболии.
Заболевания перикарда
Перикардиты - воспалительное поражение серозных оболочек, ограничивающих перикардии льную полость.По этиологии перикардиты подразделяют на инфекционные(туберкулезный, бактериальный, вирусный) и асептические(постинфарктный перикардит Дресслера, уремический и др.). Все перикардиты принято подразделять на экссудативные и сухие (слипчивые), патогенез которых имеет существенные различия.
Экссудативный перикардитобычно протекает остро и начинается с повышения температу-
ры, развития лейкоцитоза и увеличения СОЭ. К этим симптомам воспаления присоединяются патологические проявления, связанные с накоплением экссудата в плевральной полости. В нормальных условиях в полости перикарда находится 2-5 мл жидкости. При выраженной экссудации и быстром увеличении количества жидкости в полости перикарда ее объем может составить 250-400 мл. Известны случаи, когда у хронических больных во время однократной пункции удаляли до 10 л экссудата. Если экссудат накапливается очень быстро, возникает опасность резкого нарушения гемодинамики - тампонады сердца,которая развивается в результате сдавления сердца выпотом, с последующим падением сердечного выброса и формированием острой сердечной недостаточности. Она проявляется выраженной нарастающей одышкой до 40-60 дыханий в минуту, частым нитевидным пульсом, снижением систолического АД.
Слипчивый перикардитчасто называют -констриктивным перикардитом,поскольку он характеризуется сдавлением миокарда патологически измененной околосердечной сумкой. Сухой перикардит может развиться после экссу-дативного (часто недиагностированного) перикардита, однако бывает и первичным. По мере развития заболевания в полости перикарда образуются вначале нежные спайки, которые не влияют на работу сердца и общую гемодинамику, но могут провоцировать болевой синдром. Изменение гемодинамики связано в первую очередь с нарушением заполнения сердца кровью в период диастолы. Это происходит вследствие сдавления фиброзной тканью верхней и нижней полых вен. Мощные спайки могут сдавливать и миокард, затрудняя его полное расслабление в фазу диастолы. Позже спайки, достигающие толщины 1 см и более, могут полностью облитерировать полость перикарда. На заключительных этапах заболевания в рубцовой ткани откладываются соли извести, возникает кальциноз, формируется «панцирное сердце».
Заболевания ревматической природы
Ревматизм - это системное заболевание соединительной ткани,происхождение которого продолжает вызывать споры и дискуссии, поскольку оно поражает всю соединительнотканную систему, органные проявления его могут быть самыми различными (артриты, васкулиты,
ревмокардит и др.)- Тем не менее наиболее часто болезнь поражает сердце и суставы. По образному выражению французского врача XIX столетия Лассега, «ревматизм лижет суставы икусает сердце».
В этиологии ревматизма решающее значение придается Р-гемолитическому стрептококку группы А. Аргументами в пользу этого служат: возникновение ревматизма через 2-8 нед после стрептококковой инфекции; высокие титры антител к стрептококку в крови больных в активной фазе; выделение из крови в 60-75% случаев стрептококкового антигена; резкое снижение заболеваемости и рецидивов при бициллинопро-филактике. Появление латентных хронических форм ревматизма в настоящее время объясняется превращением стрептококка в безоболочечные L-формы, которые обнаруживаются при многолетней бициллинопрофилактике и персистиру-ют в органах и тканях, так как не поддаются фагоцитозу и устойчивы к антибиотикам. Рецидивы ревматизма возникают в 2,5 раза чаще у лиц с хроническим тонзиллитом. Однако ревматизмом заболевают только 0,2-0,3% перенесших ангину. Это заболевание развивается в организме, особо реагирующем на стрептококковую инфекцию. Оно возникает у лиц с генетической недостаточностью иммунитета к стрептококку (наследственная предрасположенность). Это привело к возникновению понятия «семейный ревматизм». Хотя стрептококк и рассматривается в качестве основного этиологического фактора ревматизма, тем не менее с точки зрения классической инфекционной патологии его нельзя считать возбудителем данного заболевания. Более распространенными являются представления об инфекционно-аллергическойприроде ревматизма. У лиц с генетически детерминированной недостаточностью иммунитета к стрептококку обострение хронической инфекции приводит к накоплению высокого титра иммунных комплексов (стрептококковый антиген + антитело + комплемент). Циркулируя в кровеносной системе, они фиксируются в стенке сосудов микроцирку-ляторного русла и повреждают их. В результате облегчается поступление антигенов возбудителя и белков в соединительную ткань, способствуя ее деструкции (аллергические реакции немедленного типа). Из-за общности антигенного строения стрептококка и соединительной ткани сердца иммунные реакции в оболочках последнего повреждают их с образованием аутоантигенов и
антикардиальных аутоантител. Ткани сердца связывают как противокардиальные, так и про-тивострептококковые антитела. Одни аутоанти-тела при ревматизме реагируют с сердечным антигеном, другие перекрестно - с мембраной стрептококка. Образование иммунных комплексов при этом приводит к развитию хронического воспаления в сердце (ревмокардиту).
Кроме гуморального иммунитета, при ревматизме страдает и клеточный иммунитет. В результате образуется клон сенсибилизированных лимфоцитов-киллеров, несущих на себе фиксированные антитела к сердечной мышце и эндокарду. Эти лимфоциты способны повреждать ткани сердца по типу аллергической реакции замедленного типа.
Течение ревматизма имеет хронический характер, периоды ремиссии чередуются с периодами обострения. С каждой новой атакой ревматизма экстракардиальные проявления становятся менее яркими, а ведущее значение приобретают изменения сердца, приводящие к формированию пороков сердца. Если после первой атаки порок обнаруживается только у 14-18% больных, то после второй и третьей - практически у всех пациентов.
Приобретенные пороки сердца
Приобретенные пороки сердца, которые формируются после повторных ревматических атак или возникают как осложнение септического эндокардита, очень часто определяют исход заболевания.
Недостаточность митрального клапана.Этот порок характеризуется неполным смыканием створок митрального клапана. Гемодинамичес-ки при недостаточности митрального клапана имеется постоянный обратный ток крови в систолу из левого желудочка в левое предсердие, полости которых постепенно расширяются. В течение длительного времени основная нагрузка приходится на левые отделы сердца, затем возникает застой в малом круге кровообращения и к признакам левожелудочковой недостаточности присоединяется правожелудочковая (увеличение печени, отеки). Единственным симптомом начальной стадии заболевания является систолический шум при нормальных размерах сердца. На ЭКГ изменений может не быть, затем нарастают признаки гипертрофии левых отделов сердца (увеличение размеров и массы ле-
вого желудочка). При эхокардиологическом исследовании подтверждается деформация створок митрального клапана. Недостаточность митрального клапана наиболее часто бывает ревматической этиологии. Она может возникнуть при инфекционном эндокардите, коллагенозах (системная красная волчанка), бывает врожденной.
Митральный стеноз.Стеноз атриовентрику-лярного отверстия, как правило, имеет ревматическое происхождение (реже бывает врожденным). Гемодинамически митральный стеноз наименее благоприятен, так как вся нагрузка в этом случае продолжительное время падает на левое предсердие. Сужение атриовентрикулярного отверстия («первый барьер») препятствует поступлению крови в левый желудочек, давление в левом предсердии повышается, возникает его гипертрофия. Эти компенсаторные механизмы облегчают прохождение крови через суженное митральное отверстие. Нарастание давления в левом предсердии приводит к ретроградному повышению его в легочных венах и капиллярах, формируется так называемая легочная ги-пертензия,развивается декомпенсация сердечной деятельности. Постепенно появляются морфологические изменения в сосудах легких, их склероз (органический «второй барьер»), стойкая легочная гипертензия и дилатация правых отделов, правожелудочковая недостаточность.
Ранним симптомом стеноза является одышка, при развитии легочной гипертензии нарастает цианоз. В дальнейшем возникают жалобы на сердцебиение, боли в области сердца. Аускуль-тативно выслушивается диастолический шум, обусловленный прохождением струи крови через суженное атриовентрикулярное отверстие. Митральный стеноз относится к числу наиболее неблагоприятных пороков сердца, в силу чего часто требуется хирургическая коррекция уже в детском возрасте, хотя возможна длительная компенсация.
К осложнениям стеноза левого атриовентрикулярного отверстия относятся: сердечная недостаточность, острый отек легких, легочная гипертензия, нарушения ритма и проводимости, тромбоэмболии артерии большого круга кровообращения (сосуды головного мозга, селезенки, почек). Источником артериальных эмболии являются тромбы, образующиеся в левом предсердии.
Недостаточность аортального клапана.Недостаточность аортального клапана может быть
ревматического генеза, часто возникает при септическом эндокардите, сифилисе. В результате нарушения замыкательной функции аортальных клапанов кровь из аорты в диастолу поступает в левый желудочек, который постепенно дилати-руется и гипертрофируется, возникают признаки левожелудочковой недостаточности. Развитие дальнейших событий в организме аналогично явлениям, происходящим в стадии декомпенсации сердечной недостаточности по левым отделам сердца.
Стеноз устья аорты.Ревматический стеноз устья аорты чаще присоединяется к имеющейся недостаточности аортального клапана. В результате сращения створок по комиссурам возникает препятствие выбросу крови в аорту, в ответ на это миокард левого желудочка гипертрофируется. Жалобы долго отсутствуют, и единственным указанием на наличие порока является грубый систолический шум. Появление первых жалоб свидетельствует уже о митральной недостаточности, после этого болезнь быстро прогрессирует.
Пороки трехстворчатого клапана.Пороки трехстворчатого клапана развиваются редко, как правило, при непрерывно рецидивирующем течении ревматизма. У таких больных трикуспи-дальная недостаточность или стеноз присоединяются к уже сформировавшимся порокам митрального и/или аортального клапанов. Клинически при недостаточности трехстворчатого клапана наблюдается цианоз лица, выслушивается систолический шум. Приобретенный стеноз правого атриовентрикулярного отверстия развивается редко, чаще он является врожденным.
Дата добавления: 2015-03-19; просмотров: 789;
