Инфаркт миокарда - это некроз определенного участка сердечной мышцы, который развивается в связи с резким и продолжительным уменьшением коронарного кровотока.
Чаще инфаркт миокарда поражает мышцу левого желудочка. Среди значительного числа причин, непосредственно вызывающих инфаркт миокарда («реализующие факторы»), первое место занимают стрессовые ситуации и длительная психоэмоциональная перегрузка. На втором месте находится физическое перенапряжение.
В первые сутки очаг некроза практически не отличается от неповрежденной ткани миокарда и имеет не сплошной, а мозаичный характер, поскольку среди погибших миокардиоцитов и некротизированных участков встречаются частично и даже полностью нормально функционирующие клетки и группы клеток. На вторые сутки инфаркта миокарда зона некроза постепенно отграничивается от здоровой ткани и между ними формируется периинфарктная зона,т.е. область, расположенная на границе зоны некроза и здорового миокарда. В последней, в свою очередь, можно выделить зону очаговой дистрофии,граничащую с некротическим участком, и зону обратимой ишемии,примыкающую к
неповрежденному миокарду. Изменения, возникшие в зоне очаговой дистрофии, частично обратимы, а в периинфарктяой зоне при благоприятном развитии событий могут быть полностью обратимыми.
Состояние периинфарктной зоны имеет очень большое значение для дальнейшего течения, прогноза и исхода инфаркта миокарда. Если острая ишемия не прогрессирует или устраняется, то в периинфарктной зоне быстро восстанавливаются функция и структура всех клеточных элементов. При этом зона некроза ограничивается первоначальными размерами. При недостаточном кровоснабжении дистрофические процессы впериинфарктной зоне усиливаются, карди-омиоциты гибнут, очаг некроза расширяется. Полная или частичная обратимость повреждений может сохраняться в течение 3-5 ч с момента возникновения ишемии.
Установлено, что зона некроза, превышающая 50% и более массы миокарда левого желудочка, приводит к развитию тяжелой недостаточности кровообращения, часто несовместимой с жизнью.
Эволюция зоны некроза постепенно приводит, с одной стороны, к ограничению области инфаркта миокарда, а с другой - к развитию процессов миомаляции(размягчение мышечной ткани). При этом на периферии очага некроза формируется молодая грануляционная ткань, а внутри идет рассасывание погибших кардиомиоцитов. Этот период (примерно 7-10 сут от начала заболевания) является наиболее опасным в отношении разрыва сердца,когда на фоне клинического улучшения может наступить быстрая смерть больного. При благоприятном развитии инфаркта миокарда в течение 3 нед заболевания в зоне некроза начинает интенсивно формироваться соединительная ткань. Плотный рубец при транс-муральном инфаркте миокарда окончательно образуется только через 3-4 мес. При мелкоочаговом инфаркте миокарда фиброзный рубец может образоваться через 2-3 нед.
При типичном начале инфаркта миокарда в основе его клинической картины лежат сильные боли, симптомы сердечной недостаточности, аритмии, повышение температуры, лейкоцитоз, увеличение СОЭ, гиперферментемия.
Боль- этот важнейший симптом инфаркта чаще всего заставляет обратиться пациента к врачу, но, как ни странно, патогенез болевого симптома при инфаркте миокарда до сих пор остается недостаточно изученным. Полагают, что основной причиной болей при этом заболевании
является накопление в зоне ишемии лактата, который раздражает нервные окончания афферентных симпатических волокон. Кроме того, важная роль в генезе болей отводится проста-гландинам и брадикинину, которые в больших количествах накапливаются в ишемизированной ткани. Вместе с тем в организме существуют вещества - опиоидные пептиды, которые обладают обезболивающей активностью. Следовательно, выраженность болевой симптоматики во многом может определяться «балансом» между медиаторами болевого рефлекса (лактат, простаг-ландины, брадикинин) и опиоидными пептидами.
В связи с этим нельзя не упомянуть о том, что существуют и так называемые безболевые инфаркты миокарда,при которых боль вообще отсутствует. Полагают, что такая форма инфаркта миокарда развивается у лиц с высоким уровнем эндогенного опиоидного пептида - Р-эндор-фина, являющегося мощным обезболивающим соединением. Безболевой инфаркт миокарда протекает тяжелее по сравнению с типичным проявлением данного заболевания. В какой-то мере это объясняется диагностическими ошибками при его выявлении, а следовательно, поз-дно начатым лечением. На передний план клинической картины инфаркта в этом случае выходят симптомы сердечной недостаточности и аритмии.
Примерно в 50% наблюдений боли при инфаркте миокарда появляются внезапно. Суммарная продолжительность ангинозных болей, превышающая 1 ч, свидетельствует о возможном развитии инфаркта миокарда. Локализация болей при инфаркте миокарда в некоторой степени определяется расположением очага некроза в мышце сердца и может наблюдаться за грудиной, в левой руке, начиная с плечевого сустава и ниже, в челюсти, поддиафрагмальной области и т.д. В последнем случае говорят об абдоминальной (гастралгической) форме инфаркта,которая встречается довольно часто. При этом основные боли ощущаются преимущественно в эпигастральной, умбиликальной и подреберной областях. В результате больные считают, что боли у них связаны с заболеванием органов брюшной полости. Нередко такой инфаркт миокарда может симулировать обострение язвенной болезни, острый холецистит, острый панкреатит и др.
Нитроглицерин при однократном приеме (в отличие от обычного приступа стенокардии) не
дает облегчения. Больные вынуждены принимать его повторно, многократно, до 20-40 таблеток в сутки. Появление резистентных к нитроглицерину ангинозных болей служит важным признаком, позволяющим дифференцировать обычную стенокардию от инфаркта миокарда.
Симптомы сердечной недостаточности(одышка, тахикардия, отеки и гипотензия) относятся к типичным проявлениям инфаркта миокарда. Появление этих симптомов связано с нарушением насосной функции сердца, которая снижается прямо пропорционально размеру очага некроза. Если размер зоны инфаркта составляет 50% от массы левого желудочка, то такое поражение миокарда, как правило, несовместимо с жизнью, поскольку центральная гемодинамика в этом случае страдает настолько, что нарушается кровоснабжение жизненно важных органов.
Нарушения сердечного ритмапрактически всегда сопровождают развитие инфаркта миокарда, а при его безболевой форме могут стать ведущим симптомом заболевания (аритмический инфаркт миокарда).
Основной причиной аритмий в первые 6 ч инфаркта миокарда является изменение электрофизиологических свойств кардиомиоцитов в зоне ишемии. Из-за дефицита энергетических субстратов, вызванного гипоксией, они перестают сокращаться, но сохраняют способность к проведению электрического импульса по своим мембранам. Однако вследствие недостатка АТФ эффективность работы энергозависимых ионных насосов в клетках существенно страдает, а сами ионные каналы повреждаются. Это ведет к замедлению процессов деполяризации и реполя-ризации, что создает благоприятные условия для возникновения аритмий. На более поздних сроках инфаркта клетки рабочего миокарда в зоне ишемии гибнут, а более устойчивые к гипоксии клетки проводящей системы сохраняют свою жизнеспособность, но их электрофизиологические характеристики существенно меняются. Проведение импульса по волокнам Пуркинье, расположенным в некротизированном миокарде, замедляется, а у клеток проводящей системы появляется способность к спонтанной деполяризации. В итоге формируется источник аномального эктопического автоматизма сердца.
Следует подчеркнуть, что все вышеперечисленные симптомы инфаркта миокарда (боль, признаки сердечной недостаточности, аритмии) вообще могут отсутствовать. В этом случае гово-
рят о бессимптомной («немая», silent) форме инфаркта миокарда, при которой больной не обращается за медицинской помощью, а заболевание часто остается незамеченным.
Повышение температуры, лейкоцитоз, увеличение СОЭ, гиперферментемиятакже являются характерными признаками, составляющими клиническую картину инфаркта миокарда. Коронарный кровоток в зоне ишемии никогда не падает ниже 10% от нормального уровня, поэтому в кровь из пораженного миокарда поступают продукты распада кардиомиоцитов. При этом содержание данных веществ в плазме крови возрастает прямо пропорционально размерам очага некроза. В результате формируется симп-томокомплекс, получивший название резорбци-онного синдрома.В частности, уже в конце первых - начале вторых суток начинает повышаться температура тела, что связано с резорбцией некротических масс. Для картины периферической крови в это время характерен нейтрофиль-ный лейкоцитоз (до 15*109/л - 20*109/л и более) со сдвигом влево. Скорость оседания эритроцитов (СОЭ) начинает возрастать спустя 1-3 сут после возникновения заболевания и сохра-
няется на повышенном уровне 3-4 нед, иногда дольше.
Для инфаркта миокарда характерна также гиперферментемия, т. е. повышение активности ферментов в плазме крови. При возникновении некроза они поступают из некротизированных миокардиальных клеток в кровь. При появлении инфаркта миокарда или подозрении на него активность ферментов крови: креатинфосфоки-назы (КФК), аспартатаминотрансферазы (АСАТ, или ACT), лактатдегидрогеназы (ЛДГ) должна определяться серийно. Чем больше очаг некроза, тем выше активность КФК в плазме крови. На этом принципе основан даже метод косвенного определения размеров инфаркта миокарда по математическим формулам.
Несмотря на то, что КФК в диагностике инфаркта миокарда рассматривается как один из наиболее специфичных ферментов, его активность может повышаться и при других состояниях. Это обусловлено тем, что КФК в большом количестве содержится не только в миокарде, но ив скелетных мышцах. Повышенная активность КФК может отмечаться при внутримышечных инъекциях, тромбоэмболии легочной арте-

|
рии, миокардитах, тахиаритмиях, повреждении мышц различного характера, даже после ушибов и тяжелой физической работы.
Информативным показателем развития инфаркта миокарда может быть также повышение в крови уровня миоглобина. Уровень миоглоби-на в крови больных крупноочаговым инфарктом миокарда может повышаться в 4-10 раз и более по сравнению с нормой (она колеблется от 5 до 80 нг/мл). Содержание миоглобина нормализуется через 20-40 ч после начала заболевания. По степени и длительности повышения уровня миоглобина в крови больных можно судить о величине зоны некроза и о прогнозе заболевания.
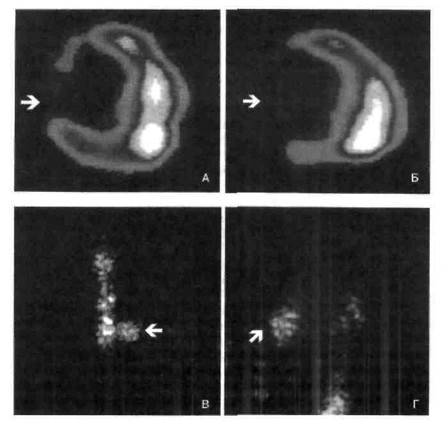
Однако если пациент попадает в стационар через трое суток после возникновения инфаркта миокарда, чточасто бывает при гастралгичес-кой или безболевой форме инфаркта миокарда, обнаружить гиперферментемию не удается. Если же у этих пациентов имеются рубцовые изменения в миокарде или блокада ножки пучка Гиса, регистрация ЭКГ не позволяет выявить признаки некроза миокарда. В этом случае для установления правильного диагноза инфаркта миокарда прибегают к проведению гамма-сцинтиг-рафии сердца (рис. 138).
Осложнения инфаркта миокарда.Осложнения инфаркта весьма существенно отягощают его течение и часто являются непосредственной причиной летальности и инвалидизации пациентов при данном заболевании. Различают ранние и поздние осложнения острой коронарной патологии.
Ранние осложнения могут возникать в первые дни, часы и даже минуты инфаркта миокарда. К ним относятся кардиогенный шок, острая сердечная недостаточность, острая аневризма сердца, разрывы сердца, тромбоэмболические осложнения, нарушения ритма и проводимости, перикардиты, острые поражения желудочно-кишечного тракта.
Поздние осложнения возникают в подостром периоде рубцевания инфаркта миокарда. Это постинфарктный перикардит (синдром Дрессле-ра), хроническая аневризма сердца, хроническая сердечная недостаточность и др.
Патогенез реперфузионного повреждения сердца
Первоначально предполагалось, что на определенном этапе полного восстановления насос-
ной функции ишемизированного миокарда можно легко добиться, возобновив коронарный кровоток. Исходя из этих соображений, отечественные кардиологи во главе с академиком Е.И.Чазовым разработали принципы тромболитической терапии инфаркта миокарда, эффективность которой оказалась наиболее высокой, если с момента коронароокклюзии проходило не более 6 ч. Для восстановления миокардиального кровообращения при хронической ИБС были разработаны различные методы хирургической ревас-куляризации, среди которых наибольшее распространение получила операция аорто-коронарно-го шунтирования(АКШ), суть которой сводится к формированию сосудистого шунта, обеспечивающего кровоток в обход склерозированного участка венечной артерии. Это позволяет ликвидировать проявления стенокардии у пациентов, страдающих данным заболеванием.
Следует указать, что восстановление коронарной перфузии часто бывает недостаточно для полной нормализации сократимости сердца. Более того, в некоторых случаях реперфузия сердца может провоцировать гибель пациентов от желудочковой фибрилляции. Оказалось, что восстановление коронарного кровотока даже после непродолжительной ишемии может вызвать ре-перфузионное повреждение сердца,для которого характерны следующие проявления: а) сократительная дисфункция сердца; б) нарушения сердечного ритма; в) феномен невосстановленного кровотока.
Реперфузионная сократительная дисфункция сердцаслагается из уменьшения силы сокращений миокарда и его неполного диастоли-ческого расслабления, в результате чего уменьшается сердечный выброс. Следует подчеркнуть, что инотропная функция сердечной мышцы под влиянием реоксигенации нарушается в меньшей степени, тогда как способность сердца расслабляться - в большей степени.
Основными механизмами реперфузионного повреждения миокарда являются так называемые «кальциевый парадокс» и «кислородный парадокс».
Кальциевый парадокс - это перегрузка кар-диомиоцитов ионами кальция.Известно, чтототальная 1-часовая ишемия изолированного сердца и его последующая реперфузия вызывают 10-кратное увеличение уровня кальция в кар-диомиоцитах. Ионы кальция в избытке проникают через сарколемму кардиомиоцитов, накап-
ливаясь в саркоплазматическом ретикулуме и митохондриях. Механизм усиленного проникновения Са2* через клеточную мембрану тесно связан с реоксигенационным нарушением Na+/Ca2* обмена. Если в норме основное поступление Са2* в клетку происходит через медленные Са2*-каналы, то вусловиях реперфузии резко активируется Nax/Ca2t-транспорт (обмен внутриклеточного Na' на внеклеточный Са2+), который осуществляется белком-переносчиком, расположенным на сарколемме. Полагают, что в основе ре-оксигенационной стимуляции Na+/Ca2* обмена лежит первоначальная перегрузка кардиомиоци-тов ионами натрия, возникающая в периоде ишемии. Следствием реализации всех указанных процессов является не только усиленное поступление кальция в клетку, но и компенсаторная аккумуляция этих ионов в СПР имитохондриях. Однако аккумулирующие способности этих внутриклеточных органелл небезграничны, иуровень кальция в цитоплазме повышается.
Кальциевая перегрузка кардиомиоцитов ведет к замедлению процесса расслабления сердца (реперфузионная контрактура), что неизбежно сопровождается уменьшением диастолического объема сердца иснижением сердечного выброса. Патогенез подобной сократительной дисфункции связан не только с замедлением релаксации кардиомиоцитов, но и с энергодефицитом, который вызван тем, что большая часть энергии, образующейся в митохондриях, расходуется на аккумуляцию Са2+ во внутриклеточных органелл ах.
Кислородный парадокс - это токсическое действие кислорода, которое испытывает миокард в момент реоксигенации после ишемии.Как известно, кислород абсолютно необходим для обеспечения процессов окислительного фосфори-лирования и синтеза АТФ. Однако в условиях реперфузии он может вызвать кардиотоксичес-кий эффект. Для того чтобы объяснить этот па-родокс, следует напомнить последовательность событий, происходящих в клетке во время ишемии. Дефицит кислорода приводит к восстановлению переносчиков электронов (НАДН-дегид-рогеназа, убихинон, цитохромы) в дыхательной цепи митохондрий. В момент реоксигенации эти переносчики становятся донорами электронов для молекул кислорода. Последние при этом превращаются в свободные радикалы (активные формы- кислорода). Активные формы кислорода повреждают молекулы ферментов, осуществля-
ющих энергозависимый транспорт ионов в кар-диомиоцитах. В результате происходит нарушение внутриклеточного ионного гомеостаза, развивается Са2*-перегрузка кардиомиоцитов и, как следствие, страдает сократительная функция сердца.
Таким образом, и кальциевый, и кислородный парадоксы приводят к перегрузке кардиомиоцитов ионами кальция. Более того, в условиях реперфузии оба эти патологических процесса взаимно усиливают друг друга.
Реперфузионные нарушения сердечного ритмавозникают в момент реоксигенации сердца и представлены главным образом желудочковыми аритмиями, патогенез которых также обусловлен кальциевым и кислородным парадоксами. Одним из важных следствий гиперкаль-циионии является активация неселективных ионных каналов, расположенных на мембране кардиомиоцитов, не функционирующих при нормальной концентрации Са2+. Стимуляция неселективных каналов ионами кальция приводит к деполяризации кардиомиоцитов до величины, достаточной для открытия быстрых Na'-каналов. Процесс заканчивается возникновением преждевременного потенциала действия, который на ЭКГ регистрируется, как экстрасистола.
Существует предположение, что в основе ре-перфузионных аритмий лежат не только кальциевый и кислородный парадоксы, но и изменения нейрогуморальных воздействий на сердце. Такие аритмии связаны с повышением тонической активности симпатоадреналовой системы и стимуляцией а-адренорецепторов миокарда эндогенным норадреналином. Все это приводит к еще большему повышению уровня внутриклеточного кальция.
Феномен невосстановленного кровотока(по reflow phenomenon) - это сохранение дефицита коронарной перфузии после возобновления магистрального кровотока в ветвях венечных артерий, питающих ишемизированные участки миокарда. В 1974г. американский физиолог Kloner установил, что феномен невосстановленного кровотока развивается при этом не ранее чем через 1-2 ч после коронароокклюзии.
Главными факторами, препятствующими восстановлению коронарной микроциркуляции после реперфузии миокарда, являются: 1) набухание клеток эндотелия; 2) агрегация форменных элементов и повышение вязкости крови; 3) образование тромбов; 4) «краевое стояние» лей-
коцитов у стенки микрососудов и инфильтрация ими сосудистой стенки. Важную роль в развитии феномена no reflow в микрососудах миокарда при транзиторной ишемии играют нейтрофи-лы, моноциты и тучные клетки. Полиморфно-ядерные лейкоциты при реперфузии в большом количестве скапливаются в микрососудах, генерируют активные формы кислорода, тромбоксан и лейкотриены, которые вызывают повреждение стенки микрососудов, их отек, что ведет к существенному сужению просвета капилляров и прекращению коронарного кровотока. Удаление лейкоцитов из периферической крови в период, предшествующий реперфузии, препятствует формированию феномена невосстановленного кровотока.
Эндогенные механизмы защиты сердца при ишемии и реперфузии
Долгое время господствовало мнение, что клетки сердца абсолютно беззащитны в отношении ишемического повреждения. Ситуация изменилась в 1986 г., когда американские физиологи Murray и Jennings в экспериментах на собаках обнаружили так называемый феномен адаптации к ишемии(ischemic preconditioning). Суть этого явления сводится к повышению устойчивости миокарда к длительной ишемии в тех случаях, если ей предшествовали несколько эпизодов 5-минутной ишемии. Результатом такого эксперимента явилось существенное повышение эффективности коронарной реперфузии, которая привела к уменьшению размера очага инфаркта миокарда и повышению устойчивости сердца к аритмогенному действию ишемии и реперфузии. Клинические наблюдения подтвердили справедливость экспериментальных данных. Оказалось, что если инфаркту миокарда предшествовали приступы стенокардии, то эффективность тромболитической терапии значительно повышается. Размеры инфаркта у таких пациентов были меньше, чем у пациентов с инфарктом миокарда, возникшим внезапно, без предшествующих ангинозных приступов.
Многочисленные исследования показали, что механизм феномена ишемической адаптации тесно связан с активацией АТФ-зависимого К+-канала (К+ДТф-канал). Во время ишемии из нервных окончаний и кардиомиоцитов, находящихся в зоне гипоперфузии, высвобождаются
биологически активные вещества (аденозин, бра-дикинин, норадреналин, ангиотензин-И, опио-идные пептиды). Каждое из этих соединений стимулирует протеинкиназу С. Последняя и активирует К+ДТФ-канал. В результате наблюдается тенденция к нормализации внутри- и внеклеточного баланса ионов. Повышение активности этого канала объясняется также снижением уровня АТФ (АТФ в норме подавляет К+ЛТФ-канал).
Существует еще адаптация сердца к ишемии на уровне целого организма.Повышенная устойчивость миокарда к ишемии формируется при физических тренировках или периодическом действии на организм гипоксии, холода, кратковременного стресса и любых других экстремальных воздействий (Ф.З. Меерсон). Иными словами, особенностью подобной адаптации является развитие ее перекрестных эффектов. Например, при адаптации к холоду одновременно повышается устойчивость миокарда к ишемии. Однако между ischemic preconditioning и адаптацией сердца к ишемии на уровне целого организма существуют значительные различия. Так, кардиопротекторный эффект первого исчезает уже через 1 ч после прекращения последнего ишемического воздействия, в то время как защитный эффект адаптации к периодическим стрессорным воздействиям сохраняется в течение нескольких дней. Феномен адаптации к ишемии формируется в течение 30 мин, тогда как для формирования защитного эффекта адаптации к стрессу требуется по меньшей мере две недели. Важную роль в формировании долговременной адаптации играет повышение активности в кардиомиоцитах и эндотелиоцитах NO-син-тетазы.
Наряду с экзогенными механизмами, обеспечивающими устойчивость сердца к ишемичес-ким воздействиям, в организме существуют и эндогенные. Как уже указывалось, важную роль в механизме реперфузионного синдрома играют активные формы кислорода. В процессе эволюции в клетках всех аэробных организмов сформировалась система противодействия токсическим эффектам свободных радикалов, образующихся в органах и тканях не только под влиянием реоксигенации, но и нормальных условиях. Эта система получила название антиоксидант-ной (см. разд. 3.1.4).
 14.3.3. Нарушения сократимости и насосной функции сердца. Недостаточность кровообращения
14.3.3. Нарушения сократимости и насосной функции сердца. Недостаточность кровообращения
Недостаточность кровообращения
Недостаточность кровообращения - это неспособность кровеносной системы обеспечивать адекватную перфузию органов и тканей.В норме сердечно-сосудистая система функционирует как единое целое. Однако при некоторых патологических состояниях, особенно острых, следует дифференцировать следующие виды недостаточности кровообращения: сердечную, сосудистую и сердечно-сосудистую (смешанную).При этом подходы к лечению сердечной или сосудистой недостаточности могут не только отличаться, но и быть взаимоисключающими. Различают компенсированную и декомпенсирован-ную стадиинедостаточности кровообращения. Первая из них характеризуется тем, что количество крови, доставляемой тканям, оказывается достаточным в покое и недостаточным для выполнения какой-либо нагрузки. Декомпенси-рованная недостаточность кровообращения клинически проявляется даже в покое. Кроме того, выделяют острую и хроническуюнедостаточность кровообращения. Сосудистая недостаточность описана в разделе, посвященном патологии сосудов (14.2.4).
Сердечная недостаточность - неспособность сердца выполнять насосную функцию вследствие существенного снижения сократительной способности миокарда, а также поражения клапанов сердца или пороков развития системы кровообращения.
К основным причинам развития сердечной недостаточности относятся: 1) первичное поражение миокарда, приводящее к нарушению его сократимости. Возникает при ИБС (постинфарктный и атеросклеротический кардиосклероз), ди-латационной кардиомиопатии, миокардитах, миокардиодистрофиях; 2) перегрузка давлением в фазу систолы. Это нарушение характеризуется увеличением работы сердца (например, при артериальной гипертензии или аортальном стенозе; 3) перегрузка объемом в фазу диастолы, сопровождающаяся увеличением работы сердца при аортальной или митральной недостаточности, дефекте межжелудочковой перегородки; 4) снижение наполнения желудочков (преимущественно диастолическая недостаточность). Раз-
вивается при гипертрофической кардиомиопатии, гипертоническом сердце (при отсутствии дилатации левого желудочка), изолированном митральном стенозе, констриктивном и экссу-дативном перикардите; 5) высокий сердечный выброс (при тиреотоксикозе, выраженной анемии и т.д.).
Классификация сердечной недостаточности.В зависимости от происхождения выделяют следующие виды сердечной недостаточности:
1) миокардиальную форму,которая обусловлена первичным поражением мышцы сердца физическими, химическими, биологическими факторами или дефицитом субстратов метаболизма;
2) перегрузочную форму,которая развивается на фоне повышенной работы миокарда по преодолению избыточного давления на путях изгнания крови из камер сердца (например, при гипертонической болезни); в связи с перегрузкой сердца увеличенным объемом крови (например, при наличии внутрисердечных шунтов) или при сочетании этих двух факторов (перегрузка объемом и давлением).
Очень часто течение миокардиальной сердечной недостаточности усугубляется присоединением ее перегрузочной формы.
По преимущественному поражению камер сердца сердечная недостаточность подразделяется на левожелудочковую, правожелудочковую и тотальную, каждая из которых, в свою очередь, может быть по характеру течения острой и хронической (ОСНи ХСН).
Левожелудочковая недостаточностьвстречается значительно чаще правожелудочковой, несмотря на то, что левый желудочек более приспособлен к повышенным нагрузкам. Это связано с тем, что различные патологические состояния чаще приводят к перегрузке левого желудочка. При острой левожелудочковой недостаточноститакими состояниями могут быть артериальная гипертензия (прежде всего гипертонический криз), инфаркт миокарда и обратимая ишемия левого желудочка, отрыв папиллярной мышцы с пролапсом митрального клапана и др. Острая левожелудочковая недостаточность клинически проявляется в виде сердечной астмы или отека легких. С морфологической точки зрения сердечная астма соответствует интерстициально-му отеку, а отек легких - альвеолярному, или истинному, отеку легких.
Хроническая левожелудочковая недостаточ-
ность(ХЛЖН) - это медленно формирующееся патологическое состояние, при котором нагрузка на левый желудочек превышает его способность совершать работу. Следует отметить, что этиологические факторы острой и хронической недостаточности сердца существенно различаются. ХЛЖН осложняет течение только хронических заболеваний сердца и сосудов.
Правожелудочковая недостаточностьхарактеризуется развитием застойных явлений в большом круге кровообращения. При этом увеличивается кровенаполнение печени и, соответственно, ее размеры, нарушается экскреторная функция почек, происходит задержка воды в организме и появляются периферические отеки. Различают острую и хроническую правожелудоч-ковую недостаточность.Наиболее частой причиной острой правожелудочковой недостаточности является распространение крупноочагового инфаркта левого желудочка на правые отделы сердца, реже - изолированный некроз миокарда правого желудочка. Очень часто причиной правожелудочковой недостаточности является легочная гипертензия, которая также может развиваться остро и хронически (разд. 14.2.3).
К весьма распространенным проявлениям перегрузки правого желудочка относятся легочное сердце и эмболия легочной артерии.
Понятие «легочное сердце»включает в себя легочную гипертензию, гипертрофию правого желудочка, его дилатацию и сердечную недостаточность. Однако в ряде случаев легочное сердце может проявляться только некоторыми из вышеназванных признаков. Так, длительное повышение АД в легочных сосудах обычно приводит к гипертрофии правого желудочка с последующим развитием сердечной недостаточности по большому кругу. Если легочная гипертензия быстро прогрессирует, то гипертрофия правого желудочка не успевает развиться и дилата-ция непосредственно переходит в правожелудоч-ковую недостаточность. Такая ситуация может иметь место и при тромбоэмболии легочной артерии, пневмотораксе, астматическом статусе и распространенной пневмонии, когда АД в малом круге повышается в течение нескольких суток или даже часов.
Дата добавления: 2015-03-19; просмотров: 2256;
