По степени тяжестигипоксия подразделяется на легкую, умеренную, тяжелуюи критическую,как правило, имеющую летальный исход.
По распространенностиразличают гипоксию общую (системную)и местную,распространя-

 ющуюся на какой-то один орган или определенную часть тела.
ющуюся на какой-то один орган или определенную часть тела.
Экзогенная гипоксия
Гипобарическая формаэкзогенной гипоксии развивается при восхождении на высокие горы и при подъеме на большую высоту с помощью летательных аппаратов открытого типа без индивидуальных кислородных приборов.
Нормобарическая формаэтого вида гипоксии может развиться при пребывании в шахтах, глубоких колодцах, подводных лодках, водолазных костюмах, у оперируемых пациентов при неисправности наркозно-дыхательной аппаратуры и в некоторых других ситуациях.
Для данного вида гипоксии характерно падение парциального давления кислорода в альвеолах, в связи с чем замедляется процесс оксиге-нации гемоглобина в легких, снижаются процент оксигемоглобина и напряжение кислорода в крови, т. е. возникает состояние гипоксемии.Вместе с тем повышается содержание в крови восстановленного гемоглобина, что сопровождается развитием цианоза.Уменьшается разница между уровнями напряжения кислорода в крови и тканях, и скорость поступления его в ткани замедляется. Наиболее низкое напряжение кислорода, при котором еще может осуществляться тканевое дыхание, называется критическим.Для артериальной крови критическое напряжение кислорода соответствует 27-33 мм рт. ст., для венозной - 19 мм рт. ст. Наряду с гипоксемией развивается гипокапнияиз-за гипервентиляции альвеол. Это ведет ксдвигу кривой диссоциации оксигемоглобина влево вследствие повышения прочности связи между гемоглобином и кислородом, что еще в большей степени затрудняет поступление кислорода в ткани. Развивается респираторный алкалоз,который в дальнейшем может смениться де-компенсированным метаболическим ацидозомиз-за накопления в тканях недоокисленных продуктов. Другим неблагоприятным следствием гипокапнии является ухудшение кровоснабжения сердца и мозгавследствие сужения артериол.
При некоторых условиях (нахождение в замкнутом пространстве ит. д.) пониженное содержание кислорода в воздухе может сочетаться с повышением парциального давления С02. В таких случаях возможно одновременное развитие
гипоксемии и гиперкапнии. Умеренная гипер-капния оказывает благоприятное влияние на кровоснабжение сердца и мозга, повышает возбудимость дыхательного центра, но значительное накопление С02 в крови сопровождается ацидозом, сдвигом кривой диссоциации оксигемоглобина вправо вследствие снижения сродства гемоглобина к кислороду, что дополнительно затрудняет процесс оксигенации крови в легких.
Гипоксия при патологических процессах в организме (эндогенная)
Дыхательная (легочная) гипоксия развивается при различных видах дыхательной недостаточности, когда по тем или другим причинам затруднено проникновение кислорода из альвеол в кровь. Это может быть связано: 1) с плохой вентиляцией альвеол, вследствие чего в них падает парциальное давление кислорода; 2) с их спадением из-за недостатка сурфактанта; 3) с уменьшением дыхательной поверхности легких вследствие понижения количества функционирующих альвеол; 4) с затруднением диффузии кислорода через альвеолярно-капиллярную мембрану; 5) с нарушением кровоснабжения ткани легких, развитием в них отека; 6) с появлением большого количества перфузируемых, но не вентилируемых альвеол; 7) с усилением шунтирования венозной крови в артериальную на уровне легких (пневмония, отек, эмболия a. pulmo-nalis) или сердца (при незаращении боталлова протока, овального отверстия и др.). Из-за этих нарушений снижается р02 в артериальной крови, уменьшается содержание оксигемоглобина, т.е. возникает состояние гипоксемии. Вместе с тем в крови возрастает содержание восстановленного гемоглобина, что способствует появлению цианоза.При гиповентиляции альвеол развивается гиперкапния,понижающая сродство гемоглобина к кислороду и затрудняющая еще больше процесс оксигенации гемоглобина в легких.
Скорость кровотока и кислородная емкость при дыхательном типе гипоксии нормальны или повышены.
Циркуляторная (сердечно-сосудистая) гипоксияразвивается при нарушениях кровообращения и может иметь генерализованный (системный) или местный характер. Причиной развития генерализованной циркуляторной гипок-
сии могут являться: 1) недостаточность функции сердца; 2) снижение сосудистого тонуса (шок, коллапс); 3) уменьшение общей массы крови в организме (гиповолемия) после острой кровопотери и при обезвоживании; 4) усиленное депонирование крови (например, в органах брюшной полости при портальной гипертензии и др.); 5) нарушение текучести крови в случаях сладжа эритроцитов и при ДВС-синдроме; 6) централизация кровообращения, что имеет место при различных видах шока.
Циркуляторная гипоксия местного характера, захватывающая какой-либо орган или область тела, может развиться при таких местных нарушениях кровообращения, как венозная гиперемия и ишемия. Для всех перечисленных состояний характерно уменьшение объемной скорости кровотока. Общее количество крови, притекающей к органам и участкам тела, снижается, соответственно уменьшается и объем доставляемого кислорода, хотя его напряжение в плазме крови и кислородная емкость могут быть нормальными. При этом виде гипоксии нередко обнаруживается нарастание коэффициента утилизации кислорода тканями вследствие увеличения времени контакта между ними и кровью при замедлении скорости кровотока, кроме того, замедление скорости кровотока способствует накоплению в тканях и капиллярах углекислоты, которая ускоряет процесс диссоциации оксигемог-лобина. Повышение утилизации кислорода тканями не происходит при усиленном шунтировании крови по артериоло-венулярным анастомозам вследствие спазма прекапиллярных сфинктеров или нарушения проходимости капилляров при сладже эритроцитов или развитии ДВС-син-дрома. В этих условиях содержание оксигемог-лобина в венозной крови может оказаться повышенным. То же происходит, когда транспорт кислорода замедлен на отрезке пути от капилляров до митохондрий, что имеет место при ин-терстициальном и внутриклеточном отеках, при снижении проницаемости стенок капилляров и клеточных мембран. Из этого следует, что для правильной оценки количества кислорода, потребленного тканями, большое значение имеет определение содержания оксигемоглобина в венозной крови.
Гемическая (кровяная) гипоксияразвивается при уменьшении кислородной емкости крови из-за снижения-содержания гемоглобина или вследствие образования его разновидностей, не
способных транспортировать кислород, таких как карбоксигемоглобин и метгемоглобин. Снижение содержания гемоглобина имеет место при различных видах анемий и при гидремии, возникающей в связи с избыточной задержкой воды в организме. При этих состояниях р02 в артериальной крови и процент оксигенации гемоглобина не отклоняются от нормы (за исключением тех случаев, когда в крови содержится карбок-си- или метгемоглобин), но снижается общее количество кислорода, связанного с'гемоглобином, и поступление его в ткани является недостаточным. При этом виде гипоксии содержание оксигемоглобина и р0.2 в венозной крови по сравнению с нормой понижены.
Образование карбоксигемоглобина происходит при отравлении окисью углерода (СО), которая присоединяется к молекуле гемоглобина в том же месте, что и кислород, причем сродство гемоглобина к СО в 250-350 раз (по данным различных авторов) превышает сродство к кислороду. При содержании в воздухе 0,1% окиси углерода более половины гемоглобина быстро превращается в карбоксигемоглобин. Как известно, СО образуется при неполном сгорании топлива, при работе двигателей внутреннего сгорания, может накапливаться в шахтах. Важным источником СО является курение. Содержание карбоксигемоглобина в крови курильщиков может достигать 1-15%, у некурящих оно составляет 1-3%. Отравление СО происходит также при вдыхании большого количества дыма при пожарах. Частым источником СО является метилен-хлорид - распространенный компонент растворителей красок. Он проникает в организм в виде паров и через кожу, поступает с кровью в печень, где расщепляется с образованием СО.
Карбоксигемоглобин не может участвовать в транспорте кислорода. Частичная замена гемоглобина на карбоксигемоглобин не только уменьшает его количество, способное переносить кислород, но и затрудняет диссоциацию оставшегося оксигемоглобина и отдачу кислорода тканям. Кривая диссоциации оксигемоглобина сдвигается влево. Поэтому инактивация 50% гемоглобина при превращении его в карбоксигемоглобин сопровождается более тяжелой гипоксией, чем недостаток 50 % гемоглобина при анемии. Утяжеляющим является и то обстоятельство, что при отравлении СО не происходит рефлекторной стимуляции дыхания, так как парциальное давление кислорода в крови остается неизменным.
 Образование карбоксигемоглобина не является полностью ответственным за токсическое действие СО. Малая фракция растворенной в плазме крови окиси углерода играет очень важную роль, так как она проникает в клетки и повышает образование в них активных радикалов кислорода и перекисное окисление ненасыщенных жирных кислот, что ведет к нарушению структуры и функции клеток, в первую очередь в ЦНС, с развитием осложнений: угнетение дыхания, падение кровяного давления; в случаях тяжелых отравлений быстро возникает состояние комы и наступает смерть. Наиболее эффективными мерами помощи при отравлении СО являются нормо- и гипербарическая оксигена-ция. Сродство окиси углерода к гемоглобину снижается при повышении температуры тела и под действием света, а также при гиперкапнии, что послужило поводом для использования кар-богена при лечении людей, отравленных СО.
Образование карбоксигемоглобина не является полностью ответственным за токсическое действие СО. Малая фракция растворенной в плазме крови окиси углерода играет очень важную роль, так как она проникает в клетки и повышает образование в них активных радикалов кислорода и перекисное окисление ненасыщенных жирных кислот, что ведет к нарушению структуры и функции клеток, в первую очередь в ЦНС, с развитием осложнений: угнетение дыхания, падение кровяного давления; в случаях тяжелых отравлений быстро возникает состояние комы и наступает смерть. Наиболее эффективными мерами помощи при отравлении СО являются нормо- и гипербарическая оксигена-ция. Сродство окиси углерода к гемоглобину снижается при повышении температуры тела и под действием света, а также при гиперкапнии, что послужило поводом для использования кар-богена при лечении людей, отравленных СО.
Метгемоглобин отличается от гемоглобина и оксигемоглобина наличием в составе гема трехвалентного железа и так же, как карбоксигемог-лобин, не способен к переносу кислорода.
Существует большое количество веществ -метгемоглобинообразователей. К их числу относятся: 1) нитросоединения (окислы азота, неорганические нитриты и нитраты, селитра, органические нитросоединения); 2) аминосоеди-нения - анилин и его производные в составе чернил, гидроксиламин, фенилгидразин и др.; 3) различные красители, например метиленовая синь; 4) окислители - бертолетова соль, перман-ганат калия, нафталин, хиноны, красная кровяная соль и др.; 5) лекарственные препараты -новокаин, аспирин, фенацитин, сульфаниламиды, ПАСК, викасол, цитрамон, анестезин и др. Вещества, вызывающие превращение гемоглобина в метгемоглобин, образуются при ряде производственных процессов: при производстве силоса, при работе с ацетиленовыми сварочно-режу-щими аппаратами, гербицидами, дефолиантами и др. Контакт с нитритами и нитратами происходит также при изготовлении взрывчатых веществ, консервировании пищевых продуктов, при сельскохозяйственных работах; нитраты часто присутствуют в питьевой воде.
Существуют наследственные формы метгемог-лобинемии, обусловленные дефицитом ферментных систем, участвующих в превращении (редукции) постоянно образующегося в малых количествах метгемоглобина в гемоглобин. Обра-
зование метгемоглобина не только снижает кислородную емкость крови, но и резко уменьшает способность оставшегося оксигемоглобина отдавать кислород тканям вследствие сдвига кривой диссоциации оксигемоглобина влево. В связи с этим уменьшается артерио-венозная разница по содержанию кислорода.
Метгемоглобинообразователи могут оказывать и непосредственное угнетающее действие на тканевое дыхание, разобщать окисление и фосфо-рилирование. Таким образом, имеется значительное сходство в механизме развития гипоксии при отравлении СО и метгемоглобинообразователя-ми. Признаки гипоксии выявляются при превращении в метгемоглобин 20-50 % гемоглобина. Превращение в метгемоглобин 75 % гемоглобина является смертельным.
При метгемоглобинемии происходит спонтанная деметгемоглобинизация благодаря активации редуктазной системы эритроцитов и накоплению недоокисленных продуктов. Этот процесс ускоряется под действием аскорбиновой кислоты и глутатиона.
При тяжелом отравлении метгемоглобинооб-разователями лечебный эффект могут оказать обменное переливание крови, гипербарическая оксигенация и вдыхание чистого кислорода.
Тканевая (гистотоксическая) гипоксия характеризуется нарушением способности тканей поглощать в нормальном объеме доставленный им кислород из-за нарушения системы клеточных ферментов в цепи транспорта электронов.
В этиологии данного вида гипоксии играют роль: 1) инактивация дыхательных ферментов: цитохромоксидазы под действием цианидов; клеточных дегидраз - под действием эфира, уре-тана, алкоголя, барбитуратов и других веществ; ингибирование дыхательных ферментов происходит также под действием ионов Си, Hg и Ag; 2) нарушение синтеза дыхательных ферментов при дефиците витаминов В,, Вг, РР, пантотено-вой кислоты; 3) понижение сопряжения процессов окисления и фосфорилирования при действии разобщающих факторов (отравление нитритами, микробными токсинами, тиреоидными гормонами и др.); 4) повреждение митохондрий ионизирующей радиацией, продуктами перекисного окисления липидов, токсически действующими метаболитами при уремии, кахексии, тяжелых инфекциях. Гистотоксическая гипоксия может развиться также при отравлении эндотоксинами.
|
При тканевой гипоксии, обусловленной разобщением процессов окисления и фосфо-рилирования, потребление кислорода тканями может возрастать, однако превалирующее количество образующейся энергии рассеивается в виде тепла и не может использоваться для нужд клетки. Синтез макроэргических соединений снижен и не покрывает потребностей тканей, они находятся в таком же состоянии, как при недостатке кислорода.
Подобное состояние возникает и при отсутствии в клетках субстратов для окисления, чтоимеет место при тяжелой форме голодания. На этом основании выделяют субстратную гипоксию.
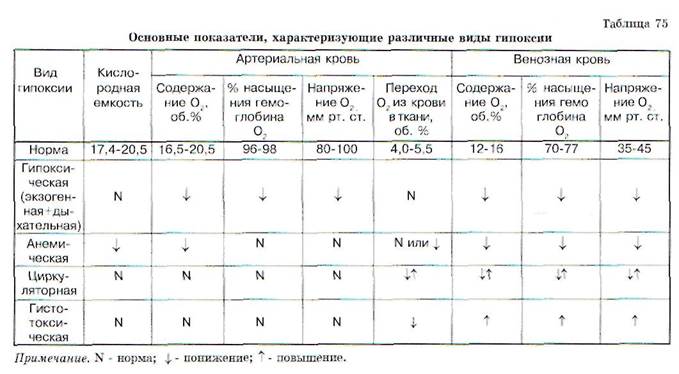
При гистотоксической и субстратной формах гипоксии напряжение кислорода и процент ок-сигемоглобина в артериальной крови нормальны, а в венозной крови - повышены. Артерио-венозная разница в содержании кислорода падает вследствие снижения утилизации кислорода тканями. Цианоз при данных видах гипоксии не развивается (табл. 75).
Смешанные формы гипоксииявляются наиболее частыми. Они характеризуются сочетанием двух или более основных типов гипоксии: 1) при травматическом шоке наряду с циркулятор-ной может развиться дыхательная форма гипоксии в связи с нарушением микроциркуляции в
легких («шоковое легкое»); 2) при тяжелой анемии или массивном образовании карбокси- или метгемоглобина развивается гипоксия миокарда, это ведет к снижению его функции, падению кровяного давления - в результате на анемическую гипоксию наслаивается циркуляторная; 3) отравление нитратами вызывает гемическую и тканевые формы гипоксии, так как под действием этих ядов происходит не только образование метгемоглобина, но и разобщение процессов окисления и фосфолирирования. Разумеется, смешанные формы гипоксии могут оказать более выраженное повреждающее действие, чем какой-либо один вид гипоксии, так как приводят к срыву ряда компенсаторно-приспособительных реакций.
Развитию гипоксии способствуют состояния, при которых возрастает потребность в кислороде, - лихорадка, стресс, высокая физическая нагрузка и др.
Перегрузочная форма гипоксии (физиологическая)развивается у здоровых людей при тяжелой физической работе, когда поступление в ткани кислорода может стать недостаточным из-за высокой потребности в нем. При этом коэффициент потребления кислорода тканями становится очень высоким и может достигать 90% (вместо 25% в норме). Повышенной отдаче кислорода тканям способствует развивающийся при
тяжелой физической работе метаболический ацидоз, который снижает прочность связи гемоглобина с кислородом. Парциальное давление кислорода в артериальной крови нормально, так же как и содержание оксигемоглобина, а в венозной крови эти показатели резко снижены.
Компенсаторно-приспособительные реакции при гипоксии
Развитие гипоксии является стимулом для включения комплекса компенсаторных и приспособительных реакций, направленных на восстановление нормального снабжения тканей кислородом. В противодействии развитию гипоксии принимают участие системы органов кровообращения, дыхания, система крови, происходит активация ряда биохимических процессов, способствующих ослаблению кислородного голодания клеток. Приспособительные реакции, как правило, предшествуют развитию выраженной гипоксии.
Имеются существенные различия в характере компенсаторно-приспособительных реакций при острой и хронической формах гипоксии. Срочные реакции, возникающие при остро развивающейся гипоксии, выражаются в первую очередь в изменении функции органов кровообращения и дыхания. Происходит увеличение минутного объема сердца за счет как тахикардии, так и возрастания систолического объема. Повышаются артериальное давление, скорость кровотока и возврат венозной крови к сердцу, что способствует ускорению доставки кислорода тканям. В случае тяжелой гипоксии происходит централизация кровообращения - значительная часть крови устремляется к жизненно важным органам. Расширяются сосуды мозга. Гипоксия является мощным сосудорасширяющим фактором для коронарных сосудов. Объем коронарного кровотока значительно возрастает при снижении в крови содержания кислорода до 8-9 об. %. Вместе с тем суживаются сосуды мышц и органов брюшной полости. Кровоток через ткани регулируется наличием в них кислорода, и чем ниже его концентрация, тем больше крови притекает к этим тканям.
Сосудорасширяющим действием обладают продукты распада АТФ (АДФ, АМФ, неорганический фосфат), а также СО.,, Н*-ионы, молочная кислота. При гипоксии их количество возрастает. В условиях ацидоза понижается воз-
будимость а-адренорецепторов по отношению к катехоламинам, что также способствует расширению сосудов. Срочные приспособительные реакции со стороны органов дыхания проявляются его учащением и углублением, что способствует улучшению вентиляции альвеол. Происходит включение в акт дыхания резервных альвеол. Увеличивается кровоснабжение легких. Гипервентиляция альвеол обусловливает развитие ги-покапнии, которая повышает сродство гемоглобина к кислороду и ускоряет оксигенацию притекающей к легким крови. В течение двух суток от начала развития острой гипоксии в эритроцитах возрастает содержание 2,3-ДФГ и АТФ, что способствует ускорению отдачи кислорода тканям. К числу реакций на острую гипоксию относится увеличение массы циркулирующей крови за счет опорожнения кровяных депо и ускоренного вымывания эритроцитов из костного мозга; благодаря этому повышается кислородная емкость крови. Приспособительные реакции на уровне испытывающих кислородное голодание тканей выражаются в повышении сопряженности процессов окисления и фосфорилирования и в активации гликолиза, за счет которого могут удовлетворяться в течение короткого времени энергетические потребности клеток. При усилении гликолиза в тканях накапливается молочная кислота, развивается ацидоз, который ускоряет диссоциацию оксигемоглобина в капиллярах.
При экзогенном и дыхательном видах гипоксии огромное приспособительное значение имеет одна особенность взаимодействия гемоглобина с кислородом: снижение Р„02с 95-100 до 60 мм рт. ст. мало отражается на степени оксигена-ции гемоглобина. Так, при ро02 равном 60 мм рт. ст., 90% гемоглобина будет связано с кислородом, и если доставка оксигемоглобина тканям не будет нарушена, то и при таком существенно сниженном р02 в артериальной крови они не будут испытывать состояние гипоксии. Наконец, еще одно проявление приспособления: в условиях острой гипоксии снижается функция, а значит, и потребность в кислороде многих органов и тканей, не принимающих непосредственного участия в обеспечении организма кислородом.
Долговременные компенсаторно-приспособительные реакции возникают при хронической гипоксии на почве различных заболеваний (например, врожденных пороков сердца), при длительном пребывании в горах, при специаль-
ных тренировках в барокамерах. В этих условиях наблюдается увеличение количества эритроцитов и гемоглобина вследствие активации эрит-ропоэза под действием эритропоэтина, усиленно выделяемого почками при их гипоксии. В результате увеличиваются кислородная емкость крови и ее объем. В эритроцитах повышается содержание 2,3-ДФГ, понижающего сродство гемоглобина к кислороду, что ускоряет его отдачу тканям. Увеличиваются дыхательная поверхность легких и их жизненная емкость вследствие образования новых альвеол. У людей, живущих в горной местности на большой высоте, увеличен объем грудной клетки, развивается гипертрофия дыхательной мускулатуры. Расширяется сосудистое русло легких, повышается его кровенаполнение, что может сопровождаться гипертрофией миокарда в основном за счет правого сердца. В миокарде и дыхательных мышцах возрастает содержание миоглобина. Вместе с тем в клетках различных тканей увеличивается количество митохондрий и повышается сродство дыхательных ферментов к кислороду. Увеличивается емкость микроциркуляторного русла в мозге и сердце за счет расширения капилляров. У людей, находящихся в состоянии хронической гипоксии (например, при сердечной или дыхательной недостаточности), увеличивается васкуляризация периферических тканей. Одним из признаков этого является увеличение размеров концевых фаланг с утратой нормального угла ногтевого ложа. Другое проявление компенсации при хронической гипоксии - это развитие коллатерального кровообращения там, где имеется затруднение для кровотока.
Существует некоторое своеобразие адаптационных процессов при каждом виде гипоксии. Приспособительные реакции в меньшей степени могут проявляться со стороны патологически измененных органов, ответственных за развитие гипоксии в каждом конкретном случае. Например, гемическая и гипоксическая (экзо-генная+дыхательная) гипоксии могут вызвать увеличение минутного объема сердца, тогда как циркуляторная гипоксия, возникающая при сердечной недостаточности, не сопровождается такой приспособительной реакцией.
Механизмы развития компенсаторныхи приспособительных реакций при гипоксии.Изменения функции органов дыхания и кровообращения, возникающие при острой гипоксии, являются в основном рефлекторными.
Они обусловлены раздражением дыхательного центра и хеморецепторов дуги аорты и каротид-ной зоны низким напряжением кислорода в артериальной крови. Эти рецепторы чувствительны также к изменению содержания С02 и ЕР-ионов, но в меньшей степени, чем дыхательный центр. Тахикардия может быть результатом прямого действия гипоксии на проводящую систему сердца. Сосудорасширяющим действием обладают продукты распада АТФ и ряд других ранее упомянутых тканевых факторов, количество которых при гипоксии возрастает.
Гипоксия является сильным стрессорным фактором, под действием которого происходит активация гипоталамо-гипофизарно-адреналовой системы, увеличивается выделение в кровь глю-кокортикоидов, которые активируют ферменты дыхательной цепи и повышают стабильность клеточных мембран, в том числе мембран лизо-сом. Это снижает опасность выделения из последних в цитоплазму гидролитических ферментов, способных вызвать аутолиз клеток.
При хронической гипоксии происходят не только функциональные сдвиги, но иструктурные изменения, имеющие большое компенсаторно-приспособительное значение. Механизм этих явлений был подробно исследован Ф. 3. Меерсо-ном с сотр. Установлено, что дефицит макроэр-гических фосфорных соединений, обусловленный гипоксией, вызывает активацию синтеза нуклеиновых кислот и белков. Итогом этих биохимических сдвигов является усиление в тканях пластических процессов, лежащих в основе гипертрофии миокардиоцитов и дыхательной мускулатуры, новообразования альвеол и новых сосудов. В результате повышается работоспособность аппарата внешнего дыхания и кровообращения. Вместе с тем функционирование этих органов становится более экономичным вследствие повышения мощности системы энергообеспечения в клетках (увеличение числа митохондрий, повышение активности дыхательных ферментов).
Установлено, что при длительной адаптации к гипоксии уменьшается продукция тиреотроп-ного и тиреоидных гормонов; это сопровождается снижением основного обмена и уменьшением потребления кислорода различными органами, в частности сердцем, при неизменной внешней работе.
Активация синтеза нуклеиновых кислот и белков при адаптации к хронической гипоксии
ЧАСТЬ III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
обнаружена и в головном мозге и способствует улучшению его функции.
Состояние устойчивой адаптации к гипоксии характеризуется уменьшением гипервентиляции легких, нормализацией функции сердца, снижением степени гипоксемии, устранением стресс-синдрома. Происходит активация стресс-лими-тирующих систем организма, в частности многократное повышение содержания опиоидных пептидов в надпочечниках [Меерсон Ф. 3. и со-авт., 1987], а также в мозге животных, подвергнутых острой или подострой гипоксии. Наряду с антистрессорным действием, опиоидные пептиды понижают интенсивность энергетического обмена и потребность тканей в кислороде. Усиливается активность ферментов, устраняющих повреждающее действие продуктов перекисного окисления липидов (супероксиддисмутазы, ка-талазы и т. д.).
Установлено, что при адаптации к гипоксии повышается резистентность организма к действию других повреждающих факторов, различного рода стрессоров. Состояние устойчивой адаптации может сохраняться в течение многих лет [Меерсон Ф. 3., 1981].
Повреждающее действие гипоксии
При резко выраженной гипоксии адаптационные механизмы могут оказаться недостаточными, происходит декомпенсация, характеризующаяся выраженными биохимическими, функциональными и структурными расстройствами.
Чувствительность различных тканей и органов к повреждающему действию гипоксии сильно варьирует. В условиях полного прекращения доставки кислорода сухожилия, хрящи и кости сохраняют свою жизнеспособность в течение многих часов; поперечно-полосатые мышцы -около двух часов; миокард, почки и печень - 20-40 мин, тогда как в коре головного мозга и в мозжечке в этих условиях уже через 2,5-3 мин появляются очаги некроза, а через 6-8 мин происходит гибель всех клеток коры головного мозга; несколько большей устойчивостью обладают нейроны продолговатого мозга - их деятельность может восстанавливаться спустя 30 мин после прекращения доставки кислорода.
Нарушение процессов обмена веществ при гипоксии. В основе всех нарушений при гипоксии лежит пониженное образование или полное
прекращение образования макроэргических фосфорных соединений, которое ограничивает способность клеток выполнять нормальные функции и поддерживать состояние внутриклеточного гомеостаза. При недостаточном поступлении в клетки кислорода усиливается процесс анаэробного гликолиза, но он может лишь в незначительной степени компенсировать ослабление окислительных процессов. В особенности это касается клеток центральной нервной системы, потребность которых в синтезе макроэргических соединений наиболее высока. В норме потребление кислорода мозгом составляет около 20% от общей потребности в нем организма. Под действием гипоксии повышается проницаемость капилляров мозга, что ведет к его отеку. Как уже упоминалось, при полном прекращении поступления кислорода в течение 2,5-3 мин начинается некроз коры и мозжечка.
Миокард также характеризуется слабой способностью к энергообеспечению за счет анаэробных процессов. Гликолиз может обеспечить потребность миокардиоцитов в энергии лишь в течение нескольких минут. Запасы гликогена в миокарде быстро истощаются. Содержание гли-колитических ферментов в миокардиоцитах незначительно. Уже через 3-4 мин после прекращения доставки к миокарду кислорода сердце теряет способность создавать артериальное давление, необходимое для поддержания кровотока в мозге, вследствие чего в нем возникают необратимые изменения.
Гликолиз не только является неадекватным способом освобождения энергии, но и оказывает отрицательное действие на другие метаболические процессы в клетках, так как в результате накопления молочной и пировиноградной кислот развивается метаболический ацидоз, который уменьшает активность тканевых ферментов; значительно снижается активность моноаминоокси-дазы. При резко выраженном дефиците макроэргов расстраивается функция энергозависимых мембранных насосов, вследствие этого нарушается регуляция перемещения ионов через клеточную мембрану. Происходят повышенный выход из клеток калия и избыточное поступление внутрь их натрия. Это ведет к понижению мембранного потенциала и изменению нервно-мышечной возбудимости, которая первоначально повышается, а затем ослабляется и утрачивается. Вслед за ионами натрия в клетки устремляется вода, это вызывает их набухание.
Кроме натрия, в клетках создается избыток кальция в связи с нарушением функции энергозависимого кальциевого насоса. Повышенное поступление кальция в нейроны обусловлено также открытием дополнительных кальциевых каналов под действием глутамата, образование которого при гипоксии вырастает. Ионы Ca2t активируют фосфолипазу А2, которая разрушает липидные комплексы клеточных мембран, что в еще большей степени нарушает работу мембранных насосов и функцию митохондрий (подробнее см. гл. 3).
Развивающийся при острой гипоксии стресс-синдром, наряду с ранее упомянутым положительным эффектом глюкокортикоидов, оказывает выраженное катаболическое действие на белковый обмен, вызывает отрицательный азотистый баланс, повышает расходование жировых запасов организма.
Повреждающее действие на клетки оказывают продукты перекисного окисления липидов, которое в условиях гипоксии усиливается. Образующиеся при этом процессе активные формы кислорода и другие свободные радикалы повреждают наружную и внутренние клеточные мембраны, в том числе мембрану лизосом. Этому способствует и развитие ацидоза. В результате этих воздействий лизосомы освобождают находящиеся в них гидролитические ферменты, оказывающие повреждающее действие на клетки вплоть до развития аутолиза.
В результате указанных метаболических расстройств клетки утрачивают способность выполнять свои функции, что лежит в основе наблюдаемых при гипоксии клинических симптомов повреждения.
Нарушение функции и структуры органов при гипоксии.Основная симптоматология при острой гипоксии обусловлена нарушением функции центральной нервной системы. Частым первичным проявлением гипоксии являются головная боль, боли в области сердца. Предполагается, что возбуждение болевых рецепторов происходит в результате раздражения их накапливающейся в тканях молочной кислотой. Другими ранними симптомами, возникающими при снижении насыщения артериальной крови кислородом до 89-85% (вместо 96 % в норме), являются состояние некоторого эмоционального возбуждения (эйфории), ослабление остроты восприятия изменений в окружающей обстановке, нарушение их критической оценки, что ведет к
неадекватному поведению. Считается, что эти симптомы обусловлены расстройством процесса внутреннего торможения в клетках коры головного мозга. В дальнейшем ослабляется тормозное влияние коры на подкорковые центры. Возникает состояние, подобное алкогольному опьянению: тошнота, рвота, нарушение координации движений, двигательное беспокойство, заторможенность сознания, судороги. Дыхание становится неритмичным. Появляется периодическое дыхание. Сердечная деятельность и сосудистый тонус падают. Может развиться цианоз. При снижении парциального давления кислорода в артериальной крови до 40-20 мм рт. ст. возникает состояние комы, угасают функции коры, подкорковых и стволовых центров головного мозга. При парциальном давлении кислорода в артериальной крови менее 20 мм рт. ст. наступает смерть. Ей может предшествовать атональное дыхание в виде глубоких редких судорожных вздохов.
Описанные функциональные изменения характерны для острой или под острой гипоксии. При молниеносной гипоксии может произойти быстрая (иногда в течение нескольких секунд) остановка сердца и паралич дыхания. Такой вид гипоксии может иметь место при отравлении большой дозой яда, блокирующего тканевое дыхание (например, цианидами).
Острая гипоксия, возникающая при отравлении СО в высокой дозе, может быстро привести к смерти, при этом потеря сознания и смерть могут наступить без каких-либо предшествующих симптомов. Описаны случаи гибели людей, находящихся в закрытом гараже при оставлении включенным двигателя машины, причем необратимые изменения могут развиться в течение 10 мин. Если летальный исход не наступил, то уотравленных СО через 3-240 дней может развиться нейропсихический синдром. К его проявлениям относят паркинсонизм, деменцию, психозы, развитие которых связано с повреждением globus pallidus и глубоко расположенного белого вещества головного мозга. В 50-75% случаев в течение года может произойти исчезновение этих расстройств.
Хронические некомпенсированные формы гипоксии,развивающиеся при длительно существующих заболеваниях органов дыхания и сердца, а также при анемиях, характеризуются понижением работоспособности в связи с быстро
ЧАСТЬ III. ПАТОФИЗИОЛОГИЯ ОРГАНОВ И СИСТЕМ
возникающим утомлением; уже при небольшой физической нагрузке у больных появляются сердцебиение, одышка, ощущение слабости. Нередко наблюдаются боли в области сердца, головная боль, головокружение.
Кроме функциональных расстройств, при гипоксии могут развиться морфологические нарушения в различных органах. Их можно подразделить на обратимые и необратимые. Обратимые нарушенияпроявляются в виде жирового перерождения в волокнах поперечно-полосатой мускулатуры, миокарде, гепатоцитах. Необратимые нарушенияпри острой гипоксии характеризуются развитием очаговых кровоизлияний во внутренние органы, в том числе в оболочки и ткань мозга, дегенеративными изменениями в коре мозга, мозжечке и подкорковых ганглиях. Может возникнуть периваскулярный отек ткани мозга. При гипоксии почек может развиться некробиоз или некроз почечных канальцев, сопровождающийся острой почечной недостаточностью. Может произойти гибель клеток в центре печеночных долек с последующим фиброзом.
Длительное кислородное голодание сопровождается повышенной гибелью паренхиматозных клеток и разрастанием соединительной ткани в различных органах.
Оксигеиотерапия
Ингаляция кислорода под нормальным или повышенным давлением (гипербарическая окси-генация) является одним из эффективных методов лечения при некоторых тяжелых формах гипоксии.
Нормобарическая оксигеиотерапияпоказана в тех случаях, когда парциальное давление кислорода в артериальной крови ниже 60 мм рт. ст., а процент оксигенации гемоглобина менее 90. Не рекомендуется проводить оксигенотера-пию при более высоком рп02, так как это лишь в незначительной степени повысит образование оксигемоглобина, но может привести к нежелательным последствиям. При гиповентиляции альвеол и при нарушении диффузии кислорода через альвеолярную мембрану кислородная терапия существенно или полностью устраняет гипоксемию.
Гипербарическая оксигенацияособенно показана при лечении больных с острой постгеморрагической анемией и при тяжелых формах отравления окисью углерода и метгемоглобино-образователями, при декомпрессионной болезни, артериальной газовой эмболии, при острой травме с развитием ишемии тканей и при ряде других тяжелых состояний. Гипербарическая оксигенация устраняет как острые, так и отдаленные эффекты отравления окисью углерода [Tibbies etal., 1996].
При введении кислорода под давлением 2,5-3 атм его фракция, растворенная в плазме крови, достигает 6 об. % , что вполне достаточно для удовлетворения потребностей тканей в кислороде без участия гемоглобина. Кислородная терапия мало эффективна при гистотоксической гипоксии и при гипоксии, обусловленной венозно-артериальным шунтированием крови при эмболии a. pulmonalis и некоторых врожденных пороках сердца и сосудов, когда значительная часть венозной крови поступает в артериальное русло, минуя легкие.
Длительно проводимая оксигенотерпия может оказать токсическое действие, которое выражается в потере сознания, развитии судорог и отеке мозга, в угнетении сердечной деятельности; в легких могут развиться нарушения, подобные таковым при респираторном дистресс-синдроме у взрослых. В механизме повреждающего действия кислорода играют роль: понижение активности многих ферментов, участвующих в клеточном метаболизме; образование большого количества свободных радикалов кислорода и усиление ПОЛ, что ведет к повреждению клеточных мембран.
Опасным до некоторой степени является применение кислородной терапии при снижении чувствительности дыхательного центра к повышению содержания С02 в крови, что имеет место у лиц пожилого и старческого возраста с наличием церебрального атеросклероза, при органических поражениях центральной нервной системы. У таких больных регуляция дыхания происходит с участием каротидных хеморецеп-торов, чувствительных к гипоксемии. Устранение ее может привести к остановке дыхания.
Глава 15 / ПАТОФИЗИОЛОГИЯ ДЫХАНИЯ
Дата добавления: 2015-03-19; просмотров: 1137;
