Процессов в идеальном газе
| № п/п | Наименование процесса | Условие (свойство) процесса | Вид условия политропы: p υn = const | Значение n |
| Изобарный | p = const | pυ0 = const (т.к. υ0 = 1) | n = 0 | |
| Изотермический | T = const или pυ = const | pυ1 = const | n = 1 | |
| Адиабатный | q = 0 (pυk = const) | pυk = const | n = k | |
| Изохорный | υ = const | pυn = const
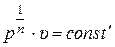
| n = 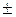 ∞
(т.к. ∞
(т.к. 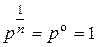 ) )
|
Данные таблицы 15.1 можно проиллюстрировать в рυ – координатах с помощью рис. 15.9, где изображены графики всех четырёх основных термодинамических процессов.
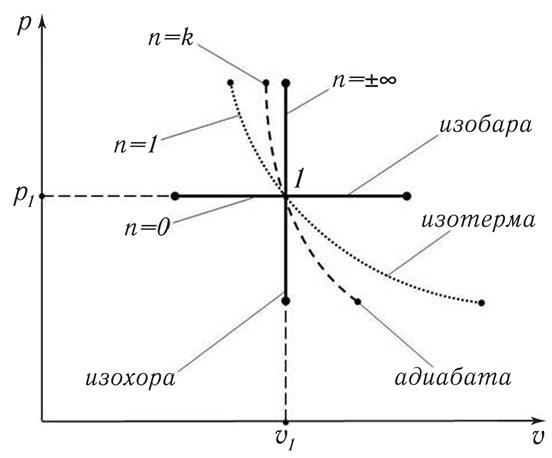
Рис. 15.9. Основные термодинамические процессы (табл. 15.1),
соответствующие значениям показателя политропы n
Из рис. 15.9 видно, что положение графиков на рυ – плоскости монотонно меняется с ростом значения показателя политропы n: от горизонтальной линии, при n = 0, до вертикальной – при n = 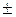 ∞.
∞.
Очевидно, что промежуточным значениям n на рис. 15.1 будут соответствовать промежуточные графики процессов. Например, если 0 < n < 1, то график политропы будет проходить между изобарой и изотермой.
Такое свойство позволяет с помощью политропного процесса описать в рυ – координатах отдельные участки у любого процесса, что часто применяется в расчётах.
Примечание:
Формула для удельной теплоёмкости идеального газа в политропном процессе (15.59) позволяет построить график зависимости с от показателя политропы n, которая имеет вид, приведённый на рис. 15.10.
Рис.15.10. Зависимость сn от n 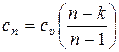 :
:
ср, сυ и k – удельные теплоёмкости при постоянном давлении, объёме и показателе адиабаты некоторого газа (например, азота) соответственно
Анализ графика на рис. 15.2 показывает:
• если n = k (адиабатный процесс), то cn = 0;
• если n < 1 и n > k, то cn >0;
• если 1 < n < k, то cn < 0;
• если n = 1 + 0 (изотермический процесс), то cn = +∞;
• если n = 1 – 0 (изотермический процесс), то cn = –∞;
Таким образом, видно, что у одного газа теплоёмкость существенно меняется в зависимости от того, в каком процессе к нему подводится (или отводится) теплота.
Дата добавления: 2015-03-19; просмотров: 1181;
