Политропный процесс
Условие, определяющее политропный процесс, записывается в виде:
р υn = const, (15.44)
где р и υ – параметры состояния системы в ходе политропного процесса: абсолютное давление и удельный объём соответственно, Па, м3,кг; n – показатель политропы (безразмерная постоянная величина, значение которой может находится в интервале от –∞ до +∞).
Условие (15.44) говорит о том, что в ходе всего политропного процесса произведение давления газа на его удельный объём в степени n остаётся постоянным. В частности, для любой промежуточной точки политропного процесса можем записать:
р υn = 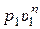 , (15.45)
, (15.45)
где р1 и υ1 – значения давления и удельного объёма в начале процесса, Па, м3/кг.
Из (15.45) можно получить уравнение политропного процесса вида:
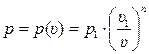 , (15.46)
, (15.46)
где р(υ) – обозначает функциональную зависимость давления от удельного объёма в политропном процессе, Па.
Связь между параметрами состояния в политропном процессе устанавливается с помощью уравнения состояния идеального газа. Запишем это уравнение для начального и конечного состояния газа точек 1 и 2:
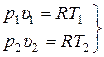 . (15.47)
. (15.47)
Разделим обе части (15.47) друг на друга:
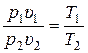 . (15.48)
. (15.48)
Записав (15.45) для конечного состояния, получаем:
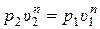 , (15.49)
, (15.49)
или
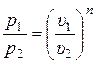 , (15.50)
, (15.50)
или
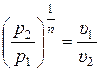 . (15.51)
. (15.51)
Подставляя (15.50) в (15.48), получаем:
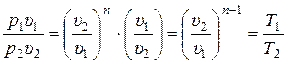 . (15.52)
. (15.52)
Подставляя (15.51) в (15.48), получаем:
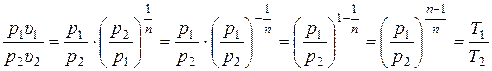 . (15.53)
. (15.53)
Исходная система уравнений (14.6) с дополнительным условием для политропного процесса имеет вид:
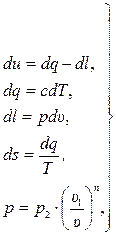 (15.54)
(15.54)
где сn – по определению удельная истинная теплоёмкость политропного процесса с показателем политропы n (неизвестная пока величина),
Дж/(кг∙К).
В результате интегрирования третьего уравнения с учётом последнего условия получаем формулу для удельной работы политропного процесса:
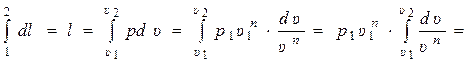
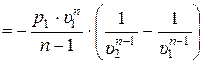 . (15.55)
. (15.55)
В результате преобразования (15.55) с учётом (15.51) и уравнения состояния идеального газа, получаем следующие формулы:
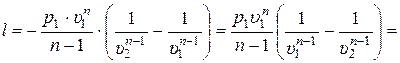
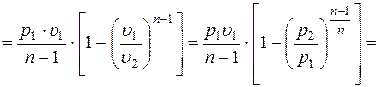
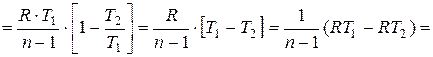
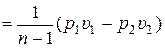 . (15.56)
. (15.56)
В результате интегрирования первого уравнения в (15.54) получаем:
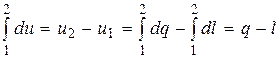
или
q = (u2 – u1) + l. (15.57)
Из (15.57), учитывая (15.56), формулу Майера и свойство идеального газа (10.16), получаем формулу для удельной теплоты политропного процесса:
q = (u2 – u1) + l = сυ · (Т2 – Т1) + 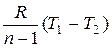 =
=
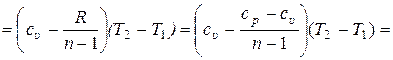
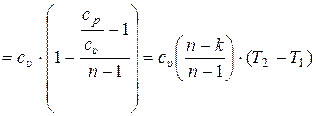 , (15.58)
, (15.58)
где сυ – удельная теплоёмкость газа при постоянном объёме, Дж/(кг · К);
n – показатель политропы; k – показатель адиабаты.
Сравнивая формулу (15.58) с определением истинной теплоёмкости политропного процесса 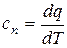 (второе уравнение в (15.54)) получаем формулу для вычисления сυ:
(второе уравнение в (15.54)) получаем формулу для вычисления сυ:
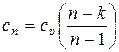 . (15.59)
. (15.59)
Формула (15.59) справедлива, так как очевидно, что при таком значении сυ после интегрирования второго уравнения в (15.54) получается формула (15.58), которая вытекает из первого закона термодинамики.
После интегрирования четвёртого уравнения в (15.54) получаем формулу для вычисления изменения энтропии газа в политропном процессе:
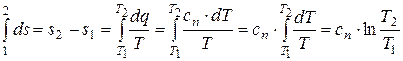 . (15.60)
. (15.60)
Политропный процесс является обобщающим термодинамическим процессом для идеального газа. Он, в частности, охватывает всю совокупность основных термодинамических процессов, что показано в табл. 15.1.
Таблица 15.1
Значение показателя политропы n для основных термодинамических
Дата добавления: 2015-03-19; просмотров: 962;
