Изобарный процесс
Условие, определяющее этот процесс: р = const или dp = 0.
В pυ-координатах изображается горизонтальными линями на рис. 15.3.
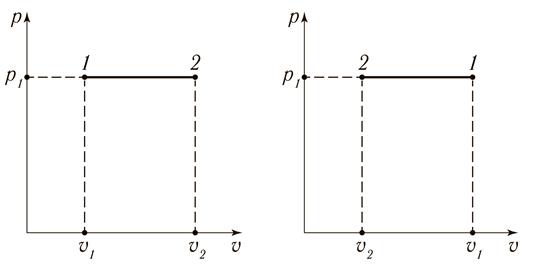
а) б)
Рис. 15.3. Изобарный процесс 1 – 2 в р υ-координатах:
а) с увеличением удельного объёма (расширение); б) с уменьшением удельного объёма (сжатие)
Соотношение между параметрами состояния в ходе изобарного процесса определяется из уравнения состояния идеального газа. Запишем его для точек 1 и 2 – начала и конца изобарного процесса:
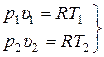 . (15.8)
. (15.8)
Разделив левые и правые части (15.1) друг на друга получаем:
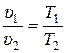 . (15.9)
. (15.9)
Равенство (15.9) показывает, что в изобарном процессе отношение удельных объёмов равно отношению температур.
Исходная система уравнений (14.6) с дополнительным условием для изобарного процесса имеет вид:
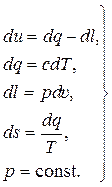 (15.10)
(15.10)
Благодаря последнему в (15.10) условию неизвестная в общем случае истинная удельная теплоёмкость с становится известной (из справочника) удельной теплоёмкостью ср при постоянном давлении. В результате в системе (15.3) число неизвестных функций становится равным числу независимых уравнений, и система становится однозначно разрешаемой.
В результате интегрирования второго уравнения в (15.10) получаем:
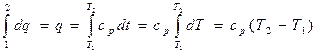 . (15.11)
. (15.11)
В результате интегрирования третьего уравнения получаем:
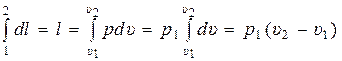 . (15.12)
. (15.12)
В результате интегрирования первого уравнения получаем:
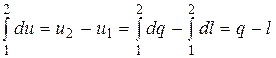 . (15.13)
. (15.13)
В результате интегрирования четвёртого уравнения получаем:
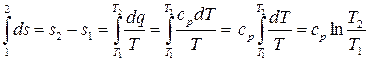 . (15.14)
. (15.14)
Выводы:
1) Из (15.13) с учётом (15.12) и того, что р1 = р2, следует:
q = u2 – u1 +l = u2 – u1 +p1 · (υ2 – υ1) = u2 – u1 +p2 υ2 – p1 υ1 =
= (u2 +p2 υ2) – (u1 + p1 υ1) = i2 – i1, (15.15)
где i1 и i2 – удельные энтальпии газа в начале и конце изобарного процесса, Дж/кг.
Формула (15.15) показывает, что теплота в изобарном процессе расходуется на изменение удельной энтальпии системы. (В то время как в изохорном – на изменение удельной внутренней энергии).
С учётом (15.11) вместо (15.15) можем записать:
i2 – i1 = ср (Т2 – Т1). (15.16)
При известной ср выражение (15.16) позволяет построить таблицы для удельной энтальпии, как функции состояния.
2) Используя уравнение идеального газа из (15.12) получаем:
l = р1 · (υ2 – υ1) = p2 υ2 – p1 υ1 = RT2 – RT1 = R · (T2 – T1). (15.17)
Рассмотрим далее случай, когда (Т2 – Т1) = 1, К. Тогда из (15.17) будем иметь:
l = R · 1, Дж/кг. (15.18)
Равенство (15.18) показывает, что газовая постоянная численно равна работе одного килограмма газа в изобарном процессе при увеличении его температуры на один градус.
3) Из (15.14) следует, что изобарный процесс в T s-координатах является логарифмической кривой, рис. 15.4.
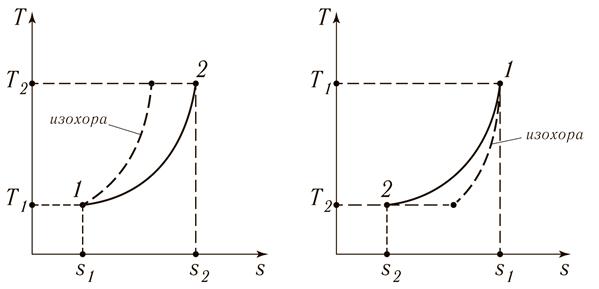
а) б)
Рис. 15.4. Изобарный процесс 1 – 2 в Ts – координатах:
а) с подводом теплоты; б) с отводом теплоты
На рис. 15.4 для качественного сравнения в том же диапазоне температур пунктирной линией изображена изохора, которая идёт круче изобары.
Дата добавления: 2015-03-19; просмотров: 2147;
