Третий закон термодинамики
Третий закон термодинамики называют ещё тепловой теоремой Нернста. Эту теорему сформулировал в 1906 году немецкий физик Нерст на базе широких экспериментальных исследований поведения вещества при низкой температуре.
Благодаря этой теореме энтропия s, а также другие, связанные с ней функцией состояния становятся численно определёнными и практически полезными.
Дело в том, что энтропия определяется через её дифференциал ds. Поэтому сама величина s определена лишь с точностью до постоянной интегрирования sо. Там, где в расчётах имеют дело с дифференциалом энтропии, эта постоянная sо не влияет на результат.
Однако, поскольку в некоторые термодинамические формулы входит произведение Т · sо. Из-за этой неопределённости практически пользоваться такими формулами было бы нельзя.
Таким образом, встаёт вопрос об абсолютном значении энтропии.
Ответом природы на этот вопрос и является теорема Нернста. В редакции Планка эта теорема звучит так:
при абсолютном нуле температуры (0, К) энтропия любого вещества принимает значение sо, не зависящее от давления, агрегатного состояния и других характеристик вещества. Эту величину sо можно принять равной нулю, получив, таким образом, абсолютную нормировку энтропии любого вещества.
То есть энтропия любой системы при абсолютном нуле всегда может быть принята равной нулю:
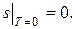 (13.1)
(13.1)
Это утверждение, подтверждаемое опытными данными, и называется третьим законом термодинамики.
Примечание:
Физический смысл энтропии можно прояснить как при анализе равновесных процессов, так и при изучении неравновесных процессов. При этом более глубокий термодинамический смыслэнтропии раскрывается при анализе неравновесных процессов. (Отметим, что все реальные процессы являются в той или иной мере неравновесными). Смысл этот состоит в том, что изменение энтропии является мерой необратимости процессов в замкнутой системе и характеризует направление естественных процессов в такой системе.
14. Основные соотношения для расчёта процессов
Дата добавления: 2015-03-19; просмотров: 804;
