Открытие энтропии
Примерно в 1860 году немецкий физик Клазиус, изучая тепловые процессы впервые пришёл к следующему выводу. У каждой термодинамической системы существует такая функция состояния, которая в ходе равновесного процесса изменяется только тогда, когда энергия к системе подводится или отводится в форме теплоты. Причём это изменение происходит таким образом, что, всегда выполняется равенство:
dQ = T · dS, (11.1)
где dQ – дифференциал (бесконечно малое приращение) теплоты, которая подводится к системе, Дж; Т – текущая температура системы, К; dS – дифференциал открытой Клазиусом новой функции состояния термодинамической системы, Дж/К.
Функцию S назвали э н т р о п и′ я. Термин греческого происхождения, который означает поворот, превращение, поворачиваюсь внутрь, способность к превращению.
Запишем (11.1) в более удобной форме для удельных величин. Для этого поделим обе части (11.1) на массу системы М, кг:
dq = T · ds,
или
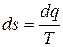 , (11.2)
, (11.2)
где q – удельная теплота процесса, Дж/кг; s – функция состояния - удельная энтропия, Дж/(кг·К).
Так как энтропия является функцией состояния, то это означает, что она является непрерывной функцией каких-то двух из трёх (р, υ, Т) параметров состояния. То есть её значение однозначно определено, например, в каждой точке рυ-плоскости. Следовательно, разность энтропий в двух разных точках определяется только положением этих точек на рυ-плоскости и не зависит от вида уравнения процесса перехода из одной точки в другую.
Докажем это, исходя из первого закона термодинамики в дифференциальном виде (9.11). Как уже отмечалось, выражение (9.11) описывает равновесные процессы, протекающие в любых термодинамических системах: в системах, находящихся в состоянии идеального газа; в системах, находящихся в состоянии реальных газов; в системах, находящихся в жидкой или твёрдой фазах. Запишем (9.11) в виде:
dq = du + p · dυ, (11.3)
где q – удельная теплота процесса, Дж/кг; u – удельная внутренняя энергия системы, Дж/кг; p – давление внутри системы, Па; υ – удельный объём системы, м3/кг.
Вначале рассмотрим доказательство справедливости утверждения (11.2) для случая, когда систему можно рассматривать как идеальный газ, то есть когда уравнение состояния системы имеет вид (см. раздел 2):
p υ = R T. (11.4)
Из (11.4) получаем:
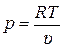 . (11.5)
. (11.5)
Обе части (11.3) делим на Т:
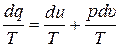 . (11.6)
. (11.6)
Подставляем в правую часть (11.6) формулы для идеального газа (11.5) и (10.16) получаем:
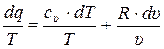 . (11.7)
. (11.7)
Для наглядности будем считать сυ постоянной величиной.
Введём в рассмотрение новую непрерывную функцию двух параметров состояния s следующего вида:
s = сυ ln T + R ln υ + const. (11.8)
Очевидно, что:
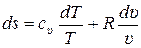 . (11.9)
. (11.9)
Сравнивая (11.9) и (11.7) получаем:
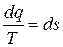 или dq = T·ds, (11.10)
или dq = T·ds, (11.10)
где s – некоторая новая функция состояния системы – непрерывная функция двух параметров состояния (11.8), Дж/(кг·К).
Полученное из первого закона термодинамики выражение (11.10) является доказательством справедливости утверждения (11.2) для идеальных газов. Справедливость утверждения (11.2) для других термодинамических систем (реальных газов, жидких и твёрдых тел) приводится в
Приложении 6.
Таким образом, выражение (11.2) можно рассматривать как определение удельной энтропиитермодинамической системы.
Для всех технически значимых веществ значения удельной энтропии определены на базе экспериментальных данных. Эти значения приводятся в справочной литературе в виде таблиц, например, в виде зависимости удельной энтропии от давления и температуры s = s (p, T).
Пример:
Рассмотрим, как можно экспериментальным методом (на основе экспериментальных данных) определить изменение удельной энтропии газа. Экспериментальные данные – это его удельная теплоёмкость при постоянном давлении ср. Для наглядности будем считать ср известной постоянной величиной.
Будем рассматривать некий процесс 1 – 2 при р = const, в котором к газу подводится теплота q.
По определению удельной теплоёмкости для такого процесса можем записать:
dq = ср dT. (11.11)
С другой стороны, по определению удельной энтропии имеем:
dq = T·ds. (11.12)
Сравнивая (11.12) и (11 11) получаем:
ср dT = T·ds или 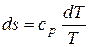 . (11.13)
. (11.13)
После интегрирования (11.13) в пределах процесса 1 – 2 получаем:
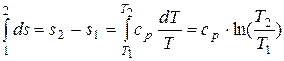 . (11.14)
. (11.14)
На базе подобных экспериментальных данных могут быть построены таблицы для энтропии, как функции температуры и давления.
Примечание:
1) Воспользовавшись определением удельной энтропии (11.2) запишем первый закон термодинамики в виде:
du = dq – dl = T ds – p dυ. (11.15)
Из (11.15) видно, что s – величина, сопряженная с Т, подобно тому как υ – величина, сопряжённая с р. То есть s и υ являются экстенсивными величинами, а р и Т – интенсивными. Экстенсивные величины изменяются под воздействием соответствующих интенсивных величин.
2) По определению удельной энтропии (11.2) можем записать:
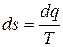 . (11.16)
. (11.16)
Это означает, что если в элементарном равновесном процессе к 1 кг некоторого вещества подводится энергия в виде теплоты в количестве dq при температуре Т, то это обязательно приведёт к изменению энтропии вещества на 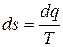 .
.
При этом следует отметить, что если в равновесном процессе такое же количество энергии будет подведено к веществу не в виде теплоты dq, а в виде работы dl, то энтропия системы не изменится ds = 0.
Дата добавления: 2015-03-19; просмотров: 974;
