Уравнение Клапейрона
В 1834 году французским физиком Клапейроном путём обобщения уже имеющихся экспериментальных данных было получено уравнение состояния идеального газа следующего вида [4]:
p υ = R T, (1)
где р, υ и Т – основные термодинамические параметры состояния – абсолютное давление, удельный объём и абсолютная температура соответственно, Па, м3/кг, К; R – газовая постоянная, имеющая своё постоянное значение для каждого конкретного газа, Дж/(кг∙К).
Величина R по смыслу является коэффициентом пропорциональности в линейной зависимости произведения (p υ) от T. Значение R определяется экспериментальным путём.
Французский учёный Клапейрон с 1820 по приблизительно 1830 год жил и работал в Санкт-Петербурге. Он преподавал в Институте инженеров путей сообщения и руководил кафедрой прикладной механики.
Примечание:
Уравнение состояния идеального газа (уравнение Клапейрона) характеризует связь между параметрами состояния p, υ и Т. Оно выводится на базе следующих экспериментальных данных [4].
В 1802 году экспериментально была установлена зависимость между объёмом газа и его температурой при условии, что давление газа остается постоянным. Эта зависимость называется законом Шарля – Г.Люсака:
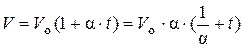 , при р = const, (1)
, при р = const, (1)
где р – абсолютное давление газа, Па; V – объём, занимаемый газами, м3; Vo – объём, который занимает рассматриваемый газ при температуре 0 оС, м3; t – температура газа, оС; α – среднее значение температурного коэффициента объёмного расширения в интервале температур от 0 до t оС, 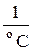 .
.
Экспериментально установлено, что
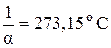 .
.
Если обе части выражения (1) разделить на массу М, кг. Получим зависимость для удельного объёма υ, м3/кг, этого газа:
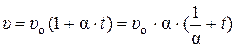 , при р = const, (2)
, при р = const, (2)
где υо – значение удельного объёма газа при 0 оС, м3/кг.
Также из экспериментов известна зависимость между давлением газа и его температурой при условии, что объём газа остаётся постоянным:
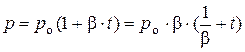 , при υ = const, (3)
, при υ = const, (3)
где ро – давление, которое имеет рассматриваемый газ при температуре 0 оС, Па; β – среднее значение температурного коэффициента давления в интервале температур от 0 до t оС, причём β = α, 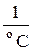 .
.
График линейной зависимости р(t) (3) представлен на рис. 1.

Рис. 1. График линейной зависимости (3)
Продолжить график на рис. 1 влево далее точки 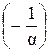 невозможно, так как абсолютное давление газа не может иметь отрицательных значений по своему определению.
невозможно, так как абсолютное давление газа не может иметь отрицательных значений по своему определению.
Введём обозначение:
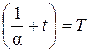 , (4)
, (4)
где Т – абсолютная температура, измеряемая в градусах Кельвина (К), шкала которой строится на базе температурной шкалы Цельсия путём переноса начала отсчёта в точку 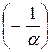 = – 273,15 °С.
= – 273,15 °С.
Таким образом, нуль отсчёта абсолютной температуры расположен при температуре – 273,15 оС, то есть сдвинут относительно нуля градусов Цельсия влево на величину 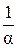 .
.
Нулевая точка отсчёта по шкале абсолютной температуры называется абсолютным нулем.
Абсолютный нуль (Т = 0 К) является самой низкой и «холодной» из всех температур. Экспериментально установлено, что охладить любое тело ниже абсолютного нуля невозможно.
С учётом (4) экспериментальные зависимости (2) и (3) примут вид:
υ = υо ∙ α ∙ Т = a ∙ Т, при р = const, (5)
р = ро ∙ α ∙ Т = b ∙ Т, при υ = const, (6)
где a и b – размерные константы, не зависящие от Т, a = υо ∙ α и b = ро ∙ α.
График линейной зависимости (6) р(Т) приведён на рис. 2.

Рис. 2. График линейной зависимости (6) р(Т)
Задолго до обнаружения зависимостей (1) и (3) в 1662 году была получена экспериментальная зависимость между давлением газа р и его удельным объёмом υ при условии, что температура Т остаётся постоянной. Эта зависимость называется законом Бойля-Мариотта [4]:
р ∙ υ = С, при Т = const, (7)
где С – постоянная величина, значение которой не зависит от р и υ, Дж/кг.
Для определения уравнения состояния идеального газа, с учётом (5) – (7), необходимо определить, как зависит от температуры Т произведение давления газа р на его удельный объём υ в общем случае, когда одновременно могут изменяться все три параметра состояния р, υ и Т. То есть требуется определить вид функции f(T), которая равна:
f(T) = f[p(T), υ(T)] = p(T) ∙ υ(T). (8)
Вычислим по (8) производную от f по Т, как производную от сложной функции f[p(T), υ(T)]:
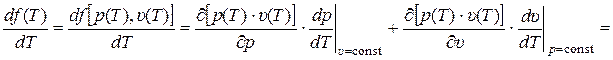
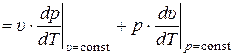 . (9)
. (9)
Из (5) и (6) получим:
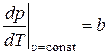 ,
, 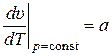 . (10)
. (10)
Подставляя (10) в (9) получаем:
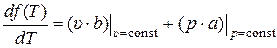 . (11)
. (11)
Оба слагаемых в правой части (11) не зависят от Т (при изменении Т их значения меняться не будут).
Введём обозначение:
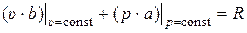 . (12)
. (12)
Очевидно, что R также не зависит от Т. После интегрирования (11) с учётом (12) получаем:
f(T) = R T + A, (13)
где А – постоянная интегрирования, значение которой можно определить с помощью (6).
Из (6) следует, что при Т = 0 значение р = 0, при условии, что
υ = const. Для этого случая из (8) и (13) следует:
f(T) = p(T) ∙ υ(T) = 0 ∙ υ(T) = R ∙ 0 + А, т.е. А = 0. (14)
Докажем, с использованием (7), что R также не зависит от р и υ. Очевидно, что в случае когда температура Т принимает любое конкретное значение Tconst, то одновременно должны выполняться равенства (7) и (8):
р ∙ υ = В, при Т =Тconst, (15)
р ∙ υ = R ∙ Тconst, (16)
где В – некоторая размерная константа, Дж/кг.
Из (15) и (16) следует, что:
В = R ∙ Тconst или 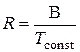 . (17)
. (17)
В (17) правая часть не зависит от р и υ при любых значениях Tconst, а значит от р и υ не зависит и R.
Таким образом, окончательно уравнение состояния идеального газа имеет вид:
р ∙ υ = R ∙ Т, (18)
где R – называется газовой постоянной, которая имеет для каждого газа своё постоянное значение, Дж/(кг∙К).
В 1874 году Менделеев преобразовал уравнение (18) к более удобному для многих расчётов виду. Для этого он привлёк дополнительные экспериментальные данные, относящиеся к закону Авогадро, точнее – к следствию из закона Авогадро для одного киломоля идеального газа при нормальных условиях (при температуре t = 0 °С и давлении р = 1 атм = 760 мм рт. ст.=
= 101325 Па).
Прежде чем сформулировать это следствие рассмотрим подробнее содержание и назначение понятия моль или киломоль (1 кмоль = 10 3 моль).
Дата добавления: 2015-03-19; просмотров: 1967;
