Конспект опорних лекцій
Коэффициенты активности переноса
Сольватация анионов:
Тенденции к сдвигу равновесия в зависимости от природы растворителя по Паркеру[23]
| Тип реакции | ДВС-растворители (спирты) | 
| Полярные НДВС-растворители |
| Кислота Брёнстеда + основание | HPic + Cl– | 
| HCl + Pic– |
| Кислота Льюиса + основание | Au(SCN)2– + 2Cl– | 
| AuCl2– + 2SCN– |
| Образование ионных пар | N(CH3)4+Pic– + Cl– | 
| N(CH3)4+Cl– + Pic– |
| Растворимость солей | KClO4  + Cl– + Cl–
| 
| KCl  + ClO4– + ClO4–
|
| Комплексообразование | AgCl  + Cl– + Cl–
| 
| AgCl2– |
Комментарии: о растворимости перхлоратов, о проблемах с хлоридсмеребряным электродом в цепях без переноса
Интерпретация произведений растворимости
Прогнозирование произведений растворимости
Значения 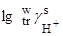 , определенные при помощи тетрафенилборатной гипотезы
, определенные при помощи тетрафенилборатной гипотезы
| Ион | Метанол | Этанол | Ацето-нитрил | Диметил-формамид | Диметил-сульфоксид |
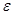 = =
| |||||
| H+ | 1.82 | 1.94 | 8.13 | –3.15 | –3.40 |
| Li+ | 0.77 | 1.92 | 4.38 | –1.75 | –2.62 |
| Na+ | 1.44 | 2.45 | 2.64 | –1.68 | –2.34 |
| K+ | 1.68 | 2.87 | 1.42 | –1.80 | –2.28 |
| Cs+ | 1.56 | 2.62 | 1.05 | –1.89 | –2.28 |
| N(CH3)4+ | 1.05 | 1.91 | 0.52 | –0.93 | –0.35 |
| N(C2H5)4+ | |||||
| N(н-C4H9)4+ | –3.68 | (–1.4) | –5.42 | –5.07 | |
| As(C6H5)4+ | –4.22 | –3.71 | –5.74 | –6.74 | –6.54 |
| Ag+ | |||||
| Cu2+ | (+4.55) | (+8.05) | +16.6 | –3.15 | –8.58 |
| CH3COO– | 2.80 | — | 10.68 | 11.6 | (8.75) |
| F– | 2.80 | — | 12.4 | 8.92 | — |
| Cl– | 2.31 | 3.54 | 7.37 | 8.45 | 7.05 |
| Br– | 1.94 | 3.18 | 5.48 | 6.34 | 4.80 |
| I– | 1.28 | 2.26 | 2.94 | 3.57 | 1.82 |
| ClO4– | 1.07 | 1.75 | 0.35 | 0.70 | — |
| SCN– | |||||
| Pic– | –1.05 | 0.08 | –0.70 | –1.22 | — |
| I3– | –2.20 | — | –2.62 | –4.72 | (–7.18) |
| B(C6H5)4– | –4.22 | –3.71 | –5.74 | –6.74 | –6.54 |
| Растворитель | 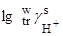
|
| Метанол | 1.52 |
| Этанол | 1.94 |
| Диметилформамид | –2.52 |
| Диметилсульфоксид | –3.40 |
| Ацетон | 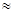 (6-7) (6-7)
|
| Пропиленкарбонат | 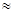 (6.5-8.8) (6.5-8.8)
|
| Ацетонитрил | 7.80 |
| Нитрометан | 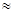 9.7 9.7
|
Сравнение данных о кислотно-основных равновесиях в различных растворителях
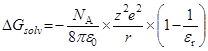
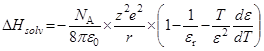
энергия Гиббса переноса иона из одного растворителя в другой:
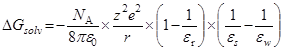
HA 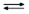 H+ + A–
H+ + A–
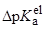 =
= 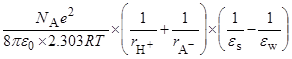 =
=
= 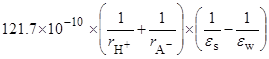
(радиусы ионов – в м). Пусть радиусы иона лиония и аниона кислоты равны 3 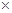 10–10 и 7
10–10 и 7 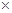 10–10 м, соответственно. Тогда можно оценить значения
10–10 м, соответственно. Тогда можно оценить значения 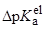 при переходе от воды к различным растворителям:
при переходе от воды к различным растворителям:
Растворитель ( 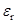 ) )
| 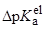
| Экспериментальные значения 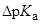 для бензойной кислоты для бензойной кислоты
|
| Метанол (32.6) | 1.03 | 5.20 |
| Этанол (24.4) | 1.63 | 6.05 |
| 1-Бутанол (17.5) | 2.57 | 7.28 |
| трет-Бутанол (12.5) | 3.90 | 10.8 |
| Формамид (109.5) | –0.21 | 2.07 |
| Диметилсульфоксид (46.5) | 0.51 | 6.9 |
| Диметилформамид (36.7) | 0.84 | 8.1 |
| Пропиленкарбонат (65.0) | 0.15 | 15.5 |
| Ацетонитрил (36.0) | 0.87 | 16.5 |
(В воде значение 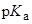 бензойной кислоты составляет 4.20 при 25 оС)
бензойной кислоты составляет 4.20 при 25 оС)
Перенос из ДМСО в ацетонитрил:
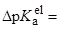
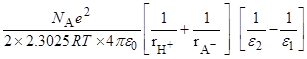
Единая шкала кислотности по Измайлову
Раститровка смесей двух кислот
С. П. Мискиджьян, А. Д. Гарновский. Введение в современную теорию кислот и оснований. Киев: Вища школа, 1979. 152 с.
А. П. Крешков. Аналитическая химия неводных растворов. М.: Химия, 1982. 256 с.
Измайлов Н.А. Электрохимия растворов. Изд. ХГУ: Харьков, 1959. 958 с.
Фиалков Ю.Я. Растворитель как средство управления химическим процессом. Л.: Химия, 1990. 240 с.
Райхардт К. Растворители и эффекты среды в органической химии. М.: Мир, 1991. 763 с.
Reichardt C. Solvents and solvent effects in organic chemistry.
Izutsu
Шатенштейн А.И. Изотопный обмен и замещение водорода в органических соединениях. М.: Изд. АН СССР, 1960. 395 с.
Бейтс Р. Определение рН. Л.: Химия, 1972. 400 с.
Белл Р. Протон в химии. М.: Мир, 1977. 384 с.
Гаммет Л. Основы физической органической химии. М.: Мир, 1972. 534 с.
Гордон Дж. Органическая химия растворов электролитов. М.: Мир, 1979. 712с.
Вайсбергер, Проскауэр, Риддик, Туппс;
Денеш;
Гордон и Форд. Спутник химика
Амис
Ничуговский
Шерман
Вредные вещества в промышленности. Л.: Химия, 1976. Т. 1, 592 с.; Т. 2, 624 с.
1. Фиалков Ю.Я., Житомирский А.Н., Тарасенко Ю.А. Физическая химия неводных растворов. Л.: Химия, 1973. 376 с.
2. Фиалков Ю. Я. Не только в воде. Л.: Химия, 1976 с.
3. Крестов Г.А. Термодинамика ионных процессов в растворах. Л.: Химия, 1984. 272 с.
4. Энтелис С.Г., Тигер Р.П. Кинетика реакций в жидкой фазе. Количественный учет влияния среды. М.: Химия, 1973. 416 с.
5. Крешков А.П. Аналитическая химия неводных растворов. М.: Химия, 1982. 256 с.
6. Титриметрические методы анализа неводных растворов. Ред. В.Д. Безуглый. М.: Химия, 1986. 384 с.
7. Карапетян Ю.А., Эйчис В.Н. Физико-химические свойства электролитных неводных растворов. М.: Химия, 1989. 256 с.
8. Александров В.В. Кислотность неводных растворов. Харьков: Вища школа, 1981. 152 с.
9. Научное наследие Н. А. Измайлова и актуальные проблемы физической химии. Харьков: Изд. ХНУ имени В. Н. Каразина, 2007. 675 с.
Вайсбергер А., Проскауэр Э., Риддик Д., Тупс Э. / Органические растворители. Физические свойства и методы очистки. - Москва: ИИЛ. - 1958. - 518 с.
Гордон А., Форд Р. / Спутник химика. - Москва: Мир. - 1976. - 541 с.
Денеш И. / Титрование в неводных средах. - Москва: Мир. - 1971. - 413 с.

Proton Affinity:
PA = – 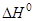 (B + H+
(B + H+ 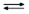 HB+)
HB+)
| NH3 | C6H5NH2 | (C6H5 )2NH | (C6H5 )3N | |
| PA, кДж/моль | 912-941 | |||
 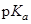 (HB+) (HB+)
| 9.27 | 4.58 | 0.9 | <0 |
HA 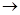 A
A  + H
+ H  , D(A–H)
, D(A–H)
A  + e–
+ e–  A– , – EA (A)
A– , – EA (A)
H 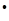
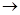 H+ + e–, IP(H)
H+ + e–, IP(H)
–––––––––––––––––
HA 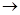 A– + H+
A– + H+
PA = D(A–H) – EA (A) + IP(H)
В газовой фазе толуол – более сильная кислота, чем вода,
а уксусная кислота и фенол оказываются практически одинаково сильными кислотами.
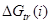 =
= 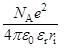
[1] В случае одноатомных спиртов сетка водородных связей двумерная. В противоположность спиртам, их тиоаналоги, меркаптаны, легколетучи (эти пахучие соединения добавляют в природный газ, что позволяет обнаруживать его утечки). Причина в том, что SH-группа является гораздо более слабым донором водородной связи, чем группа OH (о водородной связи еще будет сказано ниже).
[2] Вообще, растворимость есть важнейшее свойство системы (растворитель + растворенное вещество). Но, как справедливо указывает Ю. Я. Фиалков, смысл, вкладываемый в понятие «растворение», может быть совершенно разным, если речь идет, например, о растворении сахара в воде, основания в кислоте, газообразного хлора в воде или металлического цинка в соляной кислоте.
[3] Вязкость раствора важна также и для реакций образования новой фазы, в том числе при возникновении коллоидно-дисперсных частиц, когда характер возникающей гетерогенной (либо микрогетерогенной) системы в значительной мере определяется скоростью доставки реагирующих веществ к уже имеющимся зародышам фазы.
[4] 1 пм = 10–12 м = 0.001 нм = 0.01 Å.
[5] Например, в анионе салицилата группа COO– настолько прочно связана с группой OH, что последняя в воде диссоциирует в десять тысяч раз слабее, чем аналогичная группа фенола.
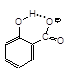
[6] Применение частично галогенированных углеводородов (CHCl3, CF3–CHClBr, CH3O–CF2–CHCl2) в качестве анестезирующих средств обязано именно склонности «остаточных» атомов водорода образовывать слабые водородные связи. Взаимодействие с карбонильной группой приводит к ослаблению пептидной связи полипептидной цепи:
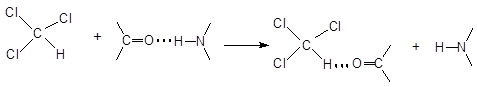
В результате такого воздействия на ионные каналы K+/Na+ в нейронных каналах нервных систем ослабляется чувствительность к боли.
[7] Вообще говоря, подобные наблюдения делались и до Дж. Льюиса, например, немецким химиком В. Майером. Кроме того, существует целый ряд теорий кислот и оснований, даже более общих, чем теория Льюиса (например, теория Усановича). О теориях кислот и оснований подробнее смотри курсы общей, неорганической и физической химии.
[8] См. библиографию в конце настоящей брошюры.
[9] Например, кипячение CCl4 с бензолом дает тетрафенилметан.
[10] Еще до Аррениуса подобную мысль высказывал русский физик Каяндер; немецкий ученый Клаузиус также допускал наличие в растворах электролитов небольшого количества свободных ионов.
[11] Ранее появление ионов допускалось лишь в ходе электролиза.
[12] Необычно ведет себя органическая соль зеленого цвета, состоящая из так называемого катиона Аграната, три(циклопропил)циклопропенилия, и так называемого аниона Куна, который собственно и обусловливает окраску соли.
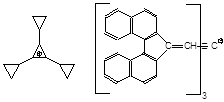
C12H15+ C67H39–
Окамото с соавторами (J. Org. Chem. 1990) было показано, что хотя в ДМСО эта соль и некоторые подобные ей диссоциируют на ионы, но в трихлорметане образуются бесцветные молекулы углеводорода, ввиду возникновения связи C–C. После удаления растворителя вновь возникает окрашенная соль. Таким образом, мы сталкиваемся с ионофорами, способными в растворах превращаться в ионогены. Это, действительно, довольно редкий случай.
[13] В данном учебном пособии мы не останавливаемся на методах определения констант равновесий. Отметим лишь, что в сложных случаях (например, для систем с низким значением 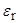 ) значения констант, получаемых из данных по электропроводимости, могут зависеть от использованного способа расчета.
) значения констант, получаемых из данных по электропроводимости, могут зависеть от использованного способа расчета.
[14] Hojo M., Miyauchi Y., Tanio A., Imai Y. J. Chem. Soc. Faraday Trans. 1991. V 87. N 4. 3847-3852.
[15] Сводка таких публикаций представлена в статье Ю.Я. Фиалкова и А.Н. Житомирского (Журн. физич. химии. 1987. Т. 61. № 2. С. 390–397.).
[16] Тот факт, что в растворе все формы электролитов в той или иной мере сольватированы (даже в так называемых инертных растворителях), представляется вполне естественным. При полном отсутствии сольватации соединение вообще не могло бы раствориться в данном растворителе. Разумеется, речь идет об истинных растворах. В случае лиофобных дисперсных систем – золей – коллоидно растворенным может быть вещество, практически не растворимое в данной жидкости молекулярно.
[17] M. Kinugasa, K. Kishi, K. Ikeda. J. Phys. Chem. 77 (1973) 1914-1918.
[18] При концентрации хлорной кислоты выше 70 % протекает реакция 3HClO4 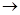 H3O+ClO4– + Cl2O7, а затем Cl2O7 разлагается на ClO2 и кислород с выделением большого количества тепла. Концентрированные растворы хлорной кислоты в органических растворителях также небезопасны. Например, одномолярный раствор HClO4 в сульфолане самопроизвольно взрывается.
H3O+ClO4– + Cl2O7, а затем Cl2O7 разлагается на ClO2 и кислород с выделением большого количества тепла. Концентрированные растворы хлорной кислоты в органических растворителях также небезопасны. Например, одномолярный раствор HClO4 в сульфолане самопроизвольно взрывается.
[19] V. Amendola, D. Esteban-Gomez, L. Fabbrizzi, M. Micchelli. Acc. Chem. Res. 39 (2006) 343-353.
[20] Pocker ?? или Leffler ??
[21] Janz G. J., Danyluk S. S. J. Am. Chem. Soc. 1959. V. 81. 3846-3850.
[22] Для этого же соединения в жидком SO2 происходит гетеролитический разрыв той же связи: 
[23] A. J. Parker. Pure Appl. Chem. 1971. Vol. 25. No. 2. P. 345-363.
Конспект опорних лекцій
Дата добавления: 2014-12-09; просмотров: 1122;
