Термодинамические потенциалы
Физическая величина, элементарное изменение которой при переходе системы из одного состояния в другое равно полученному или отданному количеству теплоты, деленному на температуру,при которой произошел этот переход, называется энтропией.
Для бесконечно малого изменения состояния системы:
dS=dQ/T.
При переходе системы из одного состояния вдругое, изменение энтропии можно рассчитать так:
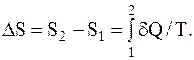
На основании первого начала термодинамики можно получить
dS=dQ/T=CVdT/T+RdV/V, а 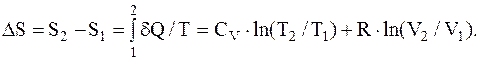
При изотермическом процессе T=const, т.е. T1=T2:
DS=R×ln(V2/V1).
При изобарическом процессе p=const, т.е. V2/V1=T2/T1:
DS=(CV+R)×ln(T2/T1)=Cp×ln(T2/T1)=Cp×ln(V2/V1).
При изохорическом процессе V=const, т.е. V1=V2:
DS=CV×ln(T2/T1).
При адиабатическом процессе dQ=0, т.е. DS=0:
S1=S2=const.
Изменения энтропии системы, совершающей цикл Карно:
DS=-(Q1/T1+Q2/T2).
Энтропия замкнутой системы, совершающей обратимый цикл Карно не изменяется:
dS=0 или S=const.
Если системой совершается необратимый цикл, то dS>0.
Таким образом, энтропия замкнутой (изолированной) системы при любых, происходящих в ней процессах не может убывать:
dS³dQ/T,
где знак равенства справедлив для обратимых процессов, а знак неравенства – для необратимых.
Второе начало термодинамики: "В изолированной системе возможны только такие процессы, при которых энтропия системы возрастает". То есть
dS³0 или dS³dQ/T.
Второе начало термодинамики определяет направление термодинамических процессов и указывает на физический смысл энтропии: энтропия – мера рассеяния энергии, т.е. характеризует ту часть энергии, которую нельзя превратить в работу.
Термодинамическими потенциалами называют определенные функции объема V, давления p, температуры T, энтропии S, числа частиц системы N и других макроскопических параметров x, характеризующих состояние термодинамической системы. К ним относятся: внутренняя энергия U=U(S,V,N,x), энтальпия H=H(S,p,N,x); свободная энергия – F=F(V,T,N,x), энергия Гиббса G=G(p,T,N,x).
Изменение внутренней энергии системы в каком-нибудь процессе определяют как алгебраическую сумму количества теплоты Q, которыми система обменивается в ходе процесса с окружающей средой, и работы А, совершенной системой или произведенной над ней. Это отражает первое начало термодинамики:
DU=Q+A.
Изменение U определяется лишь значениями внутренней энергии в начальном и конечном состояниях:
DU=U2-U1.
Для любого замкнутого процесса, возвращающего систему в первоначальное состояние, изменение внутренней энергии равно нулю (U1=U2; DU=0; Q=A).
Изменение внутренней энергии системы в адиабатическом процессе (при Q=0) равно работе, производимой над системой или произведенной системой DU=A.
В случае простейшей физической системы с малым межмолекулярным взаимодействием (идеального газа) изменение внутренней энергии сводится к изменению кинетической энергии молекул:
DU=mcVT,
где m – масса газа;
cV – удельная теплоемкость при постоянном объеме.
Энтальпия (теплосодержание, тепловая функция Гиббса) – характеризует состояние макроскопической системы в термодинамическом равновесии при выборе в качестве основных независимых переменных энтропии S и давления p – H(S,p,N,x).
Энтальпия аддитивная функция (т.е. энтальпия всей системы равна сумме энтальпий составляющих ее частей). С внутренней энергией U системы энтальпия связана соотношением:
H=U+pV,
где V – объем системы.
Полный дифференциал энтальпии (при неизменных N и x) имеет вид:
dH=TdS+Vdp.
Из этой формулы можно определить температуру T и объем V системы:
T=(dH/dS), V=(dH/dp).
При постоянном давлении теплоемкость системы
cp=(dH/dT).
Эти свойства энтальпии при постоянном давлении аналогичны свойствам внутренней энергии при постоянном объеме:
T=(dU/dS), p=-(dU/dV), cV=(dU/dT).
Свободная энергия – одно из названий изохорно-изотермического термодинамического потенциала или Гельмгольца энергии. Она определяетсякак разность между внутренней энергии термодинамической системы (U) и произведением ее энтропии (S) на температуру (T):
F=U-TS,
где TS – связанная энергия.
Энергия Гиббса – изобарно-изотермический потенциал, свободная энтальпия, характеристическая функция термодинамической системы при независимых параметрах p, T и N – G. Определяется через энтальпию H, энтропию S и температуру T равенством
G=H-TS.
Со свободной энергией – энергией Гельмгольца, энергия Гиббса связана соотношением:
G=F+pV.
Энергия Гиббса пропорциональна числу частиц N, отнесенная к одной частице, называется химическим потенциалом.
Совершаемая термодинамической системой в каком-либо процессе работа определяется убылью термодинамического потенциала, отвечающего условиям процесса. Так, при постоянстве числа частиц (N=const) в условиях теплоизоляции (адиабатический процесс, S=const) элементарная работа dA равна убыли внутренней энергии:
dA=-dU.
При изотермическом процессе (T=const)
dA=-dF
В этомпроцессе работа совершается не только за счет внутренней энергии, но и за счет поступающей в систему теплоты.
Для систем, в которых возможен обмен веществом сокружающей средой (изменение N), возможныпроцессы при постоянных p и T. В этом случае элементарная работа dA всех термодинамических сил, кроме сил давления, равна убыли термодинамического потенциала Гиббса (G), т.е.
dA=-dG.
Согласно теореме Нернста изменение энтропии (DS) при любых обратимых изотермических процессах, совершаемых между двумя равновесными состояниями при температурах, приближающихся к абсолютному нулю, стремится к нулю
limS=0. T®0.
Другая эквивалентная формулировка теоремы Нернста: "При помощи последовательности термодинамических процессов нельзя достигнуть температуры, равной абсолютному нулю".
Дата добавления: 2014-12-30; просмотров: 2289;
