Стандартные электродные потенциалы
Задача 2.1: С какими солями в водных растворах реагирует указанный металл (см. табл. 2)?
Таблица 2 – Варианты заданий
| Металл | Соли | |||||
| a | Цинк | MnSO4 | AlCl3 | Pb(NO3)2 | Hg(NO3)2 | NaCl |
| b | Никель | CuSO4 | AgNO3 | Al(NO3)3 | MnCl2 | KNO3 |
| c | Магний | Hg(NO3)2 | NaCl | ZnSO4 | Ca(NO3)2 | Na3PO4 |
| d | Железо | ZnCl2 | CuSO4 | AgNO3 | CaCl2 | MnSO4 |
| e | Олово | KNO3 | MgCl2 | Cu(NO3)2 | AgNO3 | NiSO4 |
| f | Алюминий | MgSO4 | NaCl | CuSO4 | PbSO4 | FeCl3 |
| g | Свинец | AgNO3 | Al2(SO4)3 | MnCl2 | MgCl2 | K2SO4 |
| h | Медь | MnSO4 | Pb(CH3COO)2 | AgNO3 | AlCl3 | CaSO4 |
| i | Ртуть | CaCl2 | ZnSO4 | Mg(NO3)2 | CuSO4 | MnSO4 |
| j | Марганец | ZnSO4 | Ca(NO3)2 | KNO3 | Hg(NO3)2 | AgNO3 |
| k | Олово | ZnCl2 | NiSO4 | Cu(NO3)2 | LiCl | Al2(SO4)3 |
| l | Серебро | K3PO4 | Hg(NO3)2 | Ba(NO3)2 | CuSO4 | FeSO4 |
| m | Железо | KCNS | SnCl2 | Pb(NO3)2 | CrCl3 | MgSO4 |
| n | Никель | AgNO3 | Al(NO3)3 | KCl | ZnSO4 | CaCl2 |
| o | Цинк | BaCl2 | Bi(NO3)3 | CdSO4 | K2SO4 | MnCl2 |
Пример решения задачи:
Для решения задачи воспользуйтесь значениями стандартных электродных потенциалов (СЭП). Каждый из металлов способен окисляться катионами всех других металлов, для которых величина СЭП (φ0)выше.
Непременным условием протекания реакции является соотношение: φокислителя > φвосстановителя. Так, например, металл Zn является восстановителем катионов Fe2+, Ni2+, Cu2+ и др., для которых 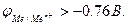
Zn + FeSO4 = ZnSO4 +Fe
Zn – 2e = Zn2+ - окисление
Fe2+ + 2e = Fe - восстановление
Дата добавления: 2014-12-05; просмотров: 1972;
