Вычисление электродных потенциалов металлических электродов
Задача 2.2: Вычислить электродный потенциал металлического электрода при заданной активной концентрации (активности) катионов металла (см. табл. 3).
Таблица 3 – Варианты заданий
| Металл | Активность ионов металла, моль/л | |
| a | Железо | 0.001 |
| b | Марганец | 0.001 |
| c | Цинк | 0.01 |
| d | Никель | 0.0001 |
| e | Хром | 0.001 |
| f | Медь | 0.001 |
| g | Серебро | 0.1 |
| h | Свинец | 0.01 |
| i | Олово | 0.0001 |
| j | Цинк | 0.0001 |
| k | Железо | 0.001 |
| l | Цинк | 0.01 |
| m | Хром | 0.001 |
| n | Олово | 0.01 |
| o | Медь | 0.001 |
Пример решения задачи:
Электродный потенциал окислительно-восстановительной системы рассчитывается по уравнению Нернста.
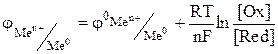 ,
,
где  стандартный электродный потенциал металла, В; n – заряд иона металла; [Ox] и [Red] – концентрация окисленной и восстановленной формы ионов металла в растворе его соли, моль/л; R- универсальная газовая постоянная, R=8.31 Дж/моль.К; Т - температура, Т=298 К; F- постоянная Фарадея, F=96500 Кл/моль.
стандартный электродный потенциал металла, В; n – заряд иона металла; [Ox] и [Red] – концентрация окисленной и восстановленной формы ионов металла в растворе его соли, моль/л; R- универсальная газовая постоянная, R=8.31 Дж/моль.К; Т - температура, Т=298 К; F- постоянная Фарадея, F=96500 Кл/моль.
Для металлических электродов при стандартных условиях (Р=101.3 кПа, Т=298 К) уравнение принимает вид:
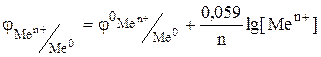 .
.
Дата добавления: 2014-12-05; просмотров: 2525;
