Электродвижущая сила гальванического элемента
Задача 2.4: Рассчитайте величину электродвижущей силы для двух указанных гальванических элементов (см. табл. 5), сравните ее значения. На основании уравнений электродных процессов запишите схемы гальванических элементов и составьте уравнения токообразующих реакций. Концентрация электролитов 0.01 моль/л.
При решении задачи используйте ряд СЭП и уравнение Нернста.
Примеры решения задачи:
Пример 1: Рассчитать электродвижущую силу (ЭДС) гальванического элемента, составленного из серебряного Ag/Ag+ и железного Fe/Fe2+ электродов при [Ag+] = 0.01 моль/л и [Fe2+] = 0.1 моль/л.
ЭДС гальванического элемента (Е) численно равна разности электродных потенциалов при разомкнутой цепи: Е = Δφ = φкатода – φанода.
По формуле Нернста рассчитаем значения электродных потенциалов
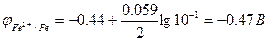
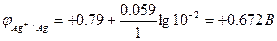
Электрод Fe/Fe2+ является анодом, Ag/Ag+ - катодом.
Е = 0.672 – (-0.47) = 1.152 В
Электродные процессы:
Анод (-): Fe – 2e = Fe2+ (окисление – анодный процесс)
Катод (+): Ag+ + 1e = Ag (восстановление – катодный процесс)
Уравнение токообразующей реакции:
Fe + 2Ag+ = Fe2+ + 2Ag
Fe + 2AgNO3 = Fe(NO3)2 + 2Ag
Схема гальванического элемента:
A(-): Fe/FeSO4 || AgNO3/Ag :(+)K
Таблица 5 – Варианты заданий
| Гальванические элементы | ||
| a | Ni/NiCl2 и Al/AlCl3 | Co/CoCl2 и Al/AlCl3 |
| b | Cr/CrCl3 и Ni/NiSO4 | Cr/CrCl3 и Co/CoCl2 |
| c | Zn/ZnSO4 и Ag/AgNO3 | Fe/FeSO4 и Ag/AgNO3 |
| d | Fe/FeSO4 и Zn/ZnSO4 | Fe/FeSO4 и Ni/NiSO4 |
| e | Cu/Cu(NO3)2 и Pb/Pb(NO3)2 | Cr/CrCl3 и Cu/Cu(NO3)2 |
| f | Ni/NiSO4 и Sn/SnCl2 | Ni/NiSO4 и Cu/Cu(NO3)2 |
| g | Mg/MgSO4 и Sn/SnSO4 | Al/Al2(SO4)3 и Mg/MgCl2 |
| h | Cr/CrCl3 и Fe/FeSO4 | Al/AlCl3 и Mg/MgSO4 |
| i | Hg/HgCl2 и Cu/CuSO4 | Mn/MnSO4 и Hg/Hg(NO3)2 |
| j | Cu/CuSO4 и Sn/SnCl2 | Mg/MgSO4 и Sn/SnSO4 |
| k | Ag/AgNO3 и Cu/CuSO4 | Sn/SnCl2 и Ni/NiSO4 |
| l | Ni/NiSO4 и Sn/SnCl2 | Au/Au(NO3)3 и Cu/Cu(NO3)2 |
| m | Zn/ZnSO4 и Ag/AgNO3 | Ni/NiSO4 и Zn/ZnSO4 |
| n | Ni/NiSO4 и Sn/SnSO4 | (Pt)H2/H2SO4 и Zn/ZnSO4 |
| o | Pb/Pb(NO3)2 и Fe/FeSO4 | Cr/CrCl3 и Cu/Cu(NO3)2 |
| p | Al/AlCl3 и Zn/ZnCl2 | Fe/FeSO4 и Ag/AgNO3 |
Пример 2: Рассчитать ЭДС концентрационного гальванического элемента, составленного из стандартного никелевого электрода и никелевого электрода при концентрации ионов Ni2+, равной 1∙10-4 моль/л.
Е = Δφ = φкатода – φанода.
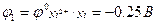
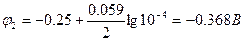
В концентрационном гальваническом элементе разность потенциалов обусловлена разной концентрацией электролита. Стандартный никелевый электрод является катодом, а никелевый электрод с меньшей концентрацией ионов Ni2+ является анодом (φ1>φ2).
Е = -0.25 – (-0.368) = 0.118 В
Схема гальванического элемента:
A (-): Ni/NiSO4 (1∙10-4 моль/л) || NiSO4 (1 моль/л)/Ni :(+) K
Дата добавления: 2014-12-05; просмотров: 7969;
