Взаимодействие металлических и шлаковых расплавов
При взаимодействии металлических и шлаковых расплавов протекают важные физико-химические процессы такие, как окисление, легирование, модифицирование, раскисление, науглероживание, десульфурация, дегазация, удаление неметаллических включений. Эти процессы протекают в сложной системе при взаимодействии нескольких фаз различной физико-химической природы.
В результате химического взаимодействия между шлаком и жидким металлом изменяется химический состав и шлака, и металла. Например, после образования шлакового покрова прекращается непосредственное взаимодействие жидкого металла с окислительной атмосферой. Однако окисление элементов химического состава сплава продолжается за счет их взаимодействия с закисью железа FeO, находящейся в шлаке, по реакциям:
Si+2FeO = SiO2+ 2Fe,
Mn + FeO = MnO +Fe,
C + FeO = CO + Fe.
Эти реакции протекают потому, что химическое сродство окисляемых элементов к кислороду выше, чем у железа.
За счет взаимодействия металлического и шлакового расплавов происходит не только окисление элементов сплава, но и удаление растворенного в жидком металле кислорода. Эта операция называется раскислением. Процессы окисления и раскисления определяются составом и свойствами газовой фазы.
Термодинамической характеристикой состава и свойств газовой фазы может служить химический потенциал компонента газовой фазы, измеренный относительно стандартного состояния μ°.
Разность химических потенциалов кислорода при стандартном состоянии, когда давление равно 1 атм., и при любом другом давлении 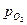 называется кислородным потенциалом:
называется кислородным потенциалом:
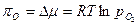 . (53)
. (53)
При изотермическом переходе моля кислорода от давления 1 атм. к давлению 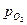 кислородный потенциал равен изменению свободной энергии системы:
кислородный потенциал равен изменению свободной энергии системы: 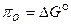 . (54)
. (54)
Для любого оксида реагирующего компонента:
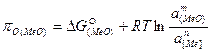 , (55)
, (55)
где a – активности оксида в шлаке и металла; n и m – стехиометрические коэффициенты реакций образования оксидов, отнесенные к молю реагирующего вещества.
Кислородный потенциал 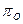 по мере увеличения прочности оксида (
по мере увеличения прочности оксида ( 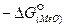 ) уменьшается, а затем понижается с уменьшением активности оксида в шлаке а(МеО) и увеличением активности элемента в металле а[МеО].
) уменьшается, а затем понижается с уменьшением активности оксида в шлаке а(МеО) и увеличением активности элемента в металле а[МеО].
В газовой фазе кислородный потенциал может быть выражен через парциальные давления:
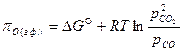 . (56)
. (56)
Условием окисления примесей металлической ванны является наличие кислородного потенциала окислителя, превышающего кислородный потенциал оксидов компонентов. При окислении железа, марганца и кремния должно быть обеспеченно неравенство
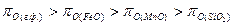 .
.
Степень полноты окисления элементов вытекает из равенства, которое может быть достигнуто в условиях равновесия:
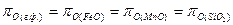 .
.
Чем меньше значение 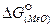 и больше прочность оксида, тем полнее пройдёт окисление того или иного элемента и большим будет соотношение
и больше прочность оксида, тем полнее пройдёт окисление того или иного элемента и большим будет соотношение 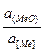 .
.
Последовательная завершенность процессов окислительных элементов можно установить на основании сравнения величин изменения свободной энергии образования различных оксидов ( 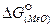 ).
).
В реальных условиях работы плавильных агрегатов в газовой фазе и шлаке поддерживается окислительный потенциал, значительно превышающий потенциал окисляемых элементов. В таких условиях реакции окисления нескольких элементов протекают одновременно, но с различными кинетическими возможностями.
В целом процесс окисления складывается из следующих элементарных процессов:
- передача окислителя из газовой фазы к шлаковой или металлической;
- преодоление межфазных границ газ - шлак или шлак – металл;
- диффузия окислителя в шлаковой или металлической фазах;
- перенос элемента к реакционной зоне;
- адсорбция элементов в реакционной зоне;
- химическое взаимодействие между окислителем и элементом;
- зарождение и развитие новой фазы из продуктов химического взаимодействия;
- удаление новой фазы из реакционной области.
Скорость суммарного процесса всегда определяется процессом, протекающим с минимальной скоростью.
ФИЗИКО – ХИМИЧЕСКИЕ ПРОЦЕССЫ ПРИ ПЛАВКЕ СТАЛИ
Дата добавления: 2014-12-05; просмотров: 2232;
