Окисление кремния
При содержании в ванне жидкого железа более 0,05% Si его окисление протекает по следующей реакции:
[Si] + 2 (FeO) = (SiO2) + 2[Fe]; ∆H = - 330,178 кДж/моль.
Образующаяся двуокись кремния SiO2 в железе практически не растворяется. Этот оксид связывается избыточным FeO с образованием низкоплавкого силиката железа по уравнению:
SiO2 + 2 FeO = (FeO)2·SiO2; ∆H = - 244,8 кДж/моль.
Реакция окисления кремния сопровождается выделением большого количества теплоты. В соответствии с принципом Ле – Шателье протеканию реакции способствует пониженная температура, характерная для периода расплавления шихты и начала окислительного периода. В течение окислительного периода содержание кремния в металлической ванне в основной печи снижается до 0,01%.
Если система была в равновесии, то нагрев приводит к обратному переходу кремния из шлака в металл. При содержании кремния свыше 4% его раскислительная способность уменьшается.
Когда процесс окисления кремния является основным, он обеспечивает расплав требуемым количеством теплоты, что обуславливает рациональное ведение последующих операций. С переходом на кислородное дутье роль кремния значительно уменьшилась. В настоящее время возможен передел в сталь чугуна, содержащего 0,5…0,6% Si.
Если окисление Si происходит в основной печи, то ванна железа находится под основным шлаком, содержащим основные оксиды, преимущественно CaO. Так как оксид кальция является более сильным основанием, чем оксид железа FeO, он вытесняет FeO из соединения с кремнием по уравнению
(FeO)2·SiO2 + 2 CaO = (CaO)2·SiO2 + 2 FeO; ∆H = - 117,34 кДж/моль.
Эта реакция протекает исключительно в шлаке, в нем повышается содержание FeO. Вследствие этого нарушается равновесие между содержанием FeO в шлаке и металлической ванне, и FeO переходит из шлака в ванну.
Образующийся силикат кальция является очень стабильным соединением и в основной печи практически не разлагается присутствующими в ванне компонентами. Поэтому восстановление кремния из шлака практически невозможно.
Если окисление кремния происходит в кислой печи, то ванна железа находится под кислым шлаком, содержащим преимущественно SiO2, очень мало CaO. В таких условиях образовавшийся оксид SiO2 в шлак из расплава не переходит, а взаимодействует с железом, происходит восстановление кремния из оксида по уравнению:
SiO2 + 2[Fe] = Si + 2 [FeO].
Образовавшийся оксид FeO в ванне немедленно восстанавливается углеродом с образованием железа и оксида углерода:
[FeO] + [С] = [Fe] + {CO}.
Количество восстановленного кремния будет тем больше, чем выше температура ванны, чем меньше концентрация FeO или кислорода в ванне и чем меньше значение константы равновесия КSi:
 .
.
В уравнении константы равновесия реакции окисления кремния принято, что активность растворителя, то есть железа, близка к единице аFe≈1; активности оксида кремния и кремния выражены через их коэффициенты активности и массовые доли.
Коэффициент распределения
 ,
,
где 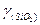 - коэффициент активности, когда за стандартное состояние чистого вещества принимают реальное состояние, для раствора выполняется закон Рауля;
- коэффициент активности, когда за стандартное состояние чистого вещества принимают реальное состояние, для раствора выполняется закон Рауля; 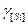 - в качестве стандартного принято условное состояние вещества, раствор подчиняется закону Генри.
- в качестве стандартного принято условное состояние вещества, раствор подчиняется закону Генри.
Дата добавления: 2014-12-05; просмотров: 1570;
