ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ СОСТОЯНИЯ
Каждое равновесное состояние термодинамической системы характеризуется определенными физическими величинами - равновесными параметрами состояния. Внутренние параметры характеризуют внутреннее состояние системы. К ним относятся давление, температура, объем и др. Внешние параметры характеризуют положение системы (координаты) во внешних силовых полях и ее скорость.
В термодинамике существует также деление параметров на термические (давление, температура, объем) и калорические (удельная энергия, удельная теплоемкость, удельные скрытые теплоты фазовых переходов).
Для характеристики конкретных условий, в которых находится данная система, или процесса, идущего в системе, необходимо прежде всего знать такие внутренние параметры состояния, как удельный объем, абсолютное давление, абсолютная температура.
Удельный объем (v, м3/кг) - это объем единицы массы или величина, определяемая отношением объема к его массе другими словами Удельный объем v есть объем единицы веса, т. е. объем в кубических метрах, занимаемый одним килограммом газа.
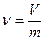 [2]
[2]
где V - объем произвольного количества вещества, м3; m - масса этого вещества, кг.
Величина, обратная удельному объему, называется плотностью (ρ, кг/м3);
Плотность это масса вещества, содержащаяся в единице объема или другими словами, масса единицы объема жидкости называется плотностью
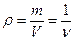 ; [3]
; [3]
Удельный вес- вес единицы объема жидкости называется удельным весом (кгс, кгс/м3, Н/м3)
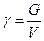
Масса и вес связаны между собой отношением
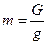 или G = mg где g – ускорение свободного падения м/с2
или G = mg где g – ускорение свободного падения м/с2
с учетом [3] получим соотношение между удельным весом и плотностью
γ = ρg
Давление - величина, определяемая отношением силы (нормальной составляющей силы), действующей на поверхность, к площади этой поверхности (р, Па = Н/м2)
Р = 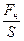 ; [4]
; [4]
где Fн - нормальная составляющая силы, [Н]; S - площадь поверхности, нормальной к действующей силе [м2]
В соответствии с молекулярно-кинетической теорией давление газа рассматривается как результат ударов молекул о стенки сосуда и определяется соотношением [5]
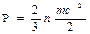
где n — число молекул в единице объема; m — масса молекулы; с2— средняя квадратичная скорость поступательного движения молекул.
Согласно Международной системе единиц (СИ) удельное давление замеряют в Ньютонах на один квадратный метр (Н/м2). Эта единица измерения давления называется Паскалем (Па). Один мегапаскаль равен 106 Па (1 МПа = 106 Па).
До настоящего времени в технике используется также старая единица измерения удельного давления - техническая атмосфера (ат), представляющая собой силу в 1 кгс, действующую на 1 см2 площади. 1 ат = 1 кгс/см2 = 104 кгс/м2 = 9,8 . 104 Н/м2 =9,8 .104 Па = 0,981 бар; 1 бар = 1,01972 кгс/см2 = 105 Па. 1кПа = 103 Па.
Различают давления атмосферное, избыточное и разрежение (вакуум). Атмосферным называется давление атмосферного воздуха на уровне моря. За величину атмосферного давления принимается давление столба ртути высотой 760 мм (одна физическая атмосфера - обозначается атм.). Таким образом, 1атм = 760 миллиметров ртутного столба (мм рт. ст.). 1 мм рт.ст. = 133 Па, 1 атм = 105 Па
Давление больше атмосферного, называется избыточным, а меньше атмосферного - разрежением. Для измерения давления применяют манометры, атмосферного давления - барометры, разрежения - вакуумметры.
Термодинамическим параметром состояния является только абсолютное давление, которое отсчитывается от абсолютного нуля давления или абсолютного вакуума.
Для измерения давления в технике применяют приборы, измеряющие не абсолютное (полное) давление (Рабс), а разность между абсолютным и атмосферным (барометрическим) давлением Ратм.
Ризб = Рабс - Рбаром ; [6] Рабс = Рбаром+ Ризб ; [7]
Приборы, применяемые для измерения давлений, больших атмосферного, называются манометрами. Они показывают избыток давления измеряемой среды над атмосферным (манометрическое давление). Для измерения давлений меньших атмосферного, применяют вакуумметры, которые показывают, насколько абсолютное давление окружающей среды меньше атмосферного. Эту недостачу давления до атмосферного называют вакуумом.
Рабс = Рбаром – Рвак ; Рвак = Рбаром - Рабс
При замере давлений жидкостными приборами вследствие расширения жидкости при нагревании ее объем увеличивается и, следовательно, увеличивается столб жидкости, что приводит к неправильным показаниям приборов. При таких замерах необходимо высоту столба жидкости приводить к 0 °С. Это приведение производится по формуле
h0 = h(1- αt)
где h0- показания барометра (манометра), приведенные к 0 °С; h- высота столба жидкости, наблюдаемая при t °С; α - объемный коэффициент расширения жидкости (для ртути α - 0,000172).
В технике применяется достаточно большое число единиц измерения давления. Соотношения между ними приведены в таблице [5].
| Единица измерения | Бар | Паскаль, Па (Н/м2) | Физическая атмосфера, атм | Техническая атмосфера, ат (кГ/см2) | Миллиметры ртутного столба, мм рт. ст. | Миллиметры водяного столба, мм вод. ст. |
| 1 бар | 105 | 0,987 | 1,02 | |||
| 1 Н/м2 | 10-5 | - | - | - | - | |
| 1 атм | 1,013 | 1,033 | ||||
| 1 ат | 0,981 | 0,968 | 735,6 | |||
| 1 мм. рт. ст. | 0,00133 | 0,001316 | 0,00136 | 13,6 | ||
| 1 мм. вод.ст. (1 кГ/м2) | 9,81 10-5 | 9,81 | 9,68- 10-5 | 10-4 | 0,0736 |
Температура.Температура любого тела — величина, характеризующая степень нагретости тела, и представляет собой меру интенсивности «теплового движения» молекул. Таким образом, температура представляет собой меру средней кинетической энергии поступательного движения его молекул, т. е. температура характеризует среднюю интенсивность движения молекул, и чем больше средняя скорость движения молекул, тем выше температура тела. Понятие температуры не может быть применено к одной или нескольким молекулам. Если два тела с различными средними кинетическими энергиями движения молекул привести в соприкосновение, то тело с большей средней кинетической энергией молекул (с большей температурой) будет отдавать энергию телу с меньшей средней кинетической энергией молекул (с меньшей температурой), и этот процесс будет протекать до тех пор пока температуры средних кинетических энергии молекул обоих тел не сравняются, т.е. не выровняются температуры обоих тел. Такое состояние двух тел называется тепловым равновесием
Другими словами если две системы находятся в тепловом контакте, то в случае неравенства их температур они будут обмениться теплотой друг с другом, если же их температуры равны, то теплообмена не будет.
С точки зрения молекулярно-кинетических представлений температура есть мера интенсивности теплового движения молекул. Ее численное значение связано величиной средней кинетической энергии молекул вещества:
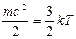 [8]
[8]
где k — постоянная Больцмана, равная 1,3800662-10-23 Дж/К. Температура Т, определенная таким образом, называется абсолютной.
В РФ для измерения температур принята стоградусная шкала и абсолютная термодинамическая шкала Кельвина. В стоградусной шкале при Рбаром.= 760 мм. рт. ст., что в системе СИ равно 101 325 н/м2, за 0° принимается температура таяния льда, а за 100° температура кипения воды. Градус этой шкалы обозначается через °С. Термометры стоградусной шкалы имеют неравномерные деления, чем учитываются некоторые изменения в зависимости коэффициента расширения жидкости от нагревания.
В отличие от стоградусной шкалы, применявшаяся ранее шкала Цельсия имела те же постоянные точки, соответствующие таянию льда при 0° и кипению воды при 100°, но равномерные деления.
В абсолютной термодинамической шкале Кельвина за нуль принято состояние тела, при котором тепловое движение молекул теоретически отсутствует. Из физики известно, что такое состояние наступает при температуре на 273° С (273,16°) ниже 0° С. Абсолютная температура всегда величина положительна.
Величина градуса по шкале Кельвина принимается равной градусу по стоградусной шкале: 1° К= 1°С; следовательно, ΔT = Δ t.
Соотношение между температурой, измеренной по абсолютной и стоградусной шкале:
0°К = -273° C; 0°С = + 273°К; Т° К = t° С + 273°; Т = -200С = 2530К
Параметром состояния газа является абсолютная температура Т° К.
Абсолютная температура - величина всегда положительная. При температуре абсолютного нуля (Т = 0 0 К = - 273,15° С) прекращается тепловое движение молекул.
Дата добавления: 2014-12-24; просмотров: 1485;
