Примеры решения задач. 4.1. Найти изменение энтропии при нагревании воды массой m==100 г от температуры t1=0 oС до температуры t2=100 oC и последующем превращении воды в пар той же
4.1. Найти изменение энтропии при нагревании воды массой m==100 г от температуры t1=0 oС до температуры t2=100 oC и последующем превращении воды в пар той же температуры.
Решение. Полное изменение энтропии в данном случае равно сумме изменения энтропии при нагревании воды и изменения энтропии системы при ее превращении в пар
DS=DS'+DS''.
Найдем изменение энтропии при нагревании воды.
Как известно, изменение энтропии выражается общей формулой
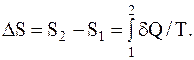
При бесконечно малом изменении температуры dT нагреваемого тела затрачивается количество теплоты
dQ=mcdT,
где m – масса тела;
c – его удельная теплоемкость.
Подставив выражение dQ для изменения энтропии при нагревании воды, будем иметь
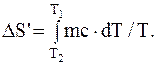
После интегрирования получим
DS=mc×ln(T2/T1).
Изменение энтропии во время превращения воды в пар при постоянной температуре
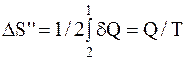 ,
,
где Q – количество теплоты, переданное при превращении нагретой воды в пар той же температуры.
Подставив выражение количества теплоты Q=lm, где l – удельная теплота парообразования, получим
DS''=lm/T.
Таким образом, искомое полное изменения энтропии будет равно
DS=mc×ln(T2/T1)+lm/T.
Подставив численные значения величин в единицах системы СИ, произведем вычисление
DS=737 Дж/К.
4.2. Определить изменение энтропии при изотермическом расширении кислорода массой m=10 г от объема V1=25 л до объема V==100 л.
Решение. Так как процесс изотермический, то в общем выражении для изменения
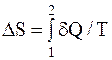
температуру выносят за знак интеграла. Выполнив это, получим
DS=Q/T.
Количество теплоты Q, полученное газом, найдем по первому началу термодинамики:
Q=DU+A.
Для изотермического процесса DU=0, следовательно, Q=A, a работа для этого процесса определяется по формуле
A=(m/m)RT×ln(V2/V1).
Дата добавления: 2014-12-30; просмотров: 4031;
