Элементы термодинамики
Первое начало термодинамики – закон сохранения и превращения энергии, которым сопровождаются термодинамические процессы. Оно утверждает: "Изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме механических эквивалентов всех внешних воздействий".
Математически первое начало термодинамики можно записать так:
dU=dQ-dA+dM,
где dU – изменение внутренней энергии системы;
dQ – элементарное количество тепла, подводимого к системе;
dA – элементарная работа, совершаемая системой;
dM – другие виды элементарных энергий.
Если dM=0, то dU=dQ-dA или dQ=dU+dA
Изотермический процесс – процесс, протекающий при постоянной температуре (T=Const ). Тогда
dQ=dU+dA=dA,
т.к. dU=CVdT=0, а U=Const, т.е. все подводимое к системе тепло идет на совершение этой системой работы.
Работа, совершаемая идеальным газом при изотермическом процессе:
а) для моля или киломоля идеального газа:
A=RT×lnV2/V1;
б) для произвольной массы газа
A=(mRT/m)×lnV2/V1.
Изобарический процесс – процесспротекающий при постоянном давлении (p=Const ).
В этом случае
dQp=dU+dA,
т.е. подводимое к системе тепло идет как на изменение ее внутренней энергии, так и на совершение этой системой работы. При этом
dQp=Cp×dT, dU=CV×dT, dA=p×dV=R×dT.
Доля подводимой к системе энергии, котораяидет на совершение работы:
dA=R/Cp×dQp=(1-1/g)dQp=(g-1)/g×dQp.
Доля этой энергии, которая идет на изменение внутренней энергии системы
dU=CV×dT=CV/Cp×dQp=dQp/g,
где – g=Cp/CV.
Изохорический процесс – процесс протекающий при постоянном объеме (V=Const).
Первое начало термодинамики
dQV=dU+dA=dU,
т.к. dA=p×dV=0, т.е. при изохорическом процессе, все подводимое к системе тепло идет на изменение ее внутренней энергии. При этом
dQV=CV×dT,
следовательно
dU=CV×dT,
DU=Cv×DT.
Изменение внутренней энергии системы пропорционально изменению ее температуры.
Процессы, протекающие без теплообмена или почти без теплообмена с окружающей средой, называют адиабатическими или адиабатными. Примером адиабатического процесса может служить быстро протекающий процесс сжатия или расширения газа.
Первое начало термодинамики при адиабатическом процессе:
dQ=dU+dA,
т.к. dQ=0, то dU+dA=0, a dU=-dA, то есть работа, совершаемая системой при адиабатическом процессе, сопровождается уменьшением ее внутренней энергии.
Зависимость между параметрами состояния системы при адиатическом процессе:
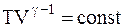 ,
,
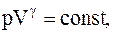
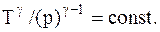
Эти уравнения называют уравнениямиПуассона.
Работа, совершаемая идеальным газом при адиабатическом процессе:
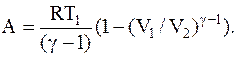
Или
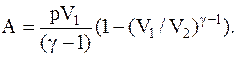
Политропическим называют процесс, при котором p и V связаны соотношением
pVn=const,
где n – показатель политропы, принимающий любые значения от -¥ до +¥.
Работа, совершаемая идеальным газом при политропическом процессе,
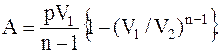
Обратимым называется процесс, который протекает так, что после его окончания систему можно вернуть в первоначальное состояние, причем ни каких изменений в окружающей систему среде не произойдет.
Процесс, протекающий так, что после его окончания систему нельзя вернуть в первоначальное состояние без изменений в окружающей среде, называется необратимым.
Круговым процессом (циклом) называется такая последовательность превращений, в результате которой система, выйдя из какого-либо исходного состояния, возвращается в него вновь.
Любой круговой процесс состоит из процессов расширения и сжатия. Процесс расширения сопровождается работой, совершаемой системой, а процесс сжатия – работой, совершаемой над системой внешними силами. Разность этих работ равна работе данного цикла.
Если работа при расширении больше, чем работа при сжатии, то такой процесс (цикл) называется прямым. В противном случае – обратным.
Для характеристики эффективности цикла вводится физическая величина, называемая коэффициентом полезного действия, равная отношению работы цикла к работе, которую можно было бы совершить при превращении в нее всего количества тепла, подведенного к системе:
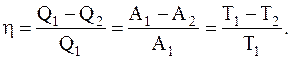
Превращение теплоты в работу используется в различных тепловых машинах. При этом более совершенной считается такая тепловая машина, у которой КПД стремится к единице.
Наиболее совершенным в отношении КПД является цикл Карно, который состоит из двух изотерм и двух адиабат.
Коэффициент полезного действия цикла Карно можно определить по формуле:
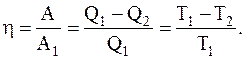
Из соотношения видно, что КПД цикла Карно независит от природы вещества, а зависит лишь от температур, при которых теплота, сообщается системе и отбирается от нее.
Коэффициент полезного действия холодильной машины (холодильника)
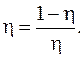
Кроме цикла Карно в технической термодинамике применяются цикл Отто, состоящий издвух адиабат и двух изохор, и цикл Дизеля, состоящий из двух адиабат, изохоры и изобары.
Дата добавления: 2014-12-30; просмотров: 2397;
