Термодинамические константы некоторых веществ
| Вещество | 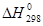 , кДж/моль , кДж/моль
| 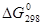 , кДж/моль , кДж/моль
| 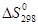 , Дж/(моль∙К) , Дж/(моль∙К)
|
| Ag (к) | 42,69 | ||
| AgBr (к) | -99,16 | -95,94 | 107,1 |
| AgCl (к) | -126,8 | -109,7 | 96,07 |
| AgI (к) | -64,2 | -66,3 | 114,2 |
| AgF (к) | -202,9 | -184,9 | 83,7 |
| AgNO3 (к) | -120,7 | -32,2 | 140,9 |
| Ag2O (к) | -30,56 | -10,82 | 121,7 |
| Ag2CO3 (к) | -506,1 | -437,1 | 167,4 |
| Al (к) | 28,31 | ||
| Al2O3 (к) | -1675,0 | 1576,4 | 50,94 |
| Al(OH)3 (к) | -1275,7 | 1139,72 | 71,1 |
| AlCl3 (к) | -697,4 | -636,8 | 167,0 |
| Al2 (SO4) 3 (к) | -3434,0 | -3091,9 | 239,2 |
| As (к) | 35,1 | ||
| As2O3 (к) | -656,8 | -575,0 | 107,1 |
| As2O5 (к) | -918,0 | -772,4 | 105,4 |
| Au (к) | 47,65 | ||
| AuF (к) | -74,3 | -58,6 | 96,4 |
| AuF3 (к) | -348,53 | -297,48 | 114,2 |
| Au(OH)3 (к) | -418,4 | -289,95 | 121,3 |
| AuCl3 (к) | -118,4 | -48,53 | 146,4 |
| B (к) | 5,87 | ||
| B2O3 (к) | -1264,0 | -1184,0 | 53,85 |
| B2H6 (г) | 31,4 | 82,8 | 232,9 |
| Ba (к) | 64,9 | ||
| BaO (к) | -556,6 | -528,4 | 70,3 |
| Be (к) | 9,54 | ||
| BeO (к) | -598,7 | -581,6 | 14,10 |
| BeCO3 (к) | -951,57 | -944,75 | 199,4 |
| Bi (к) | 56,9 | ||
| BiCl3 (г) | -270,7 | -260,2 | 356,9 |
| BiCl3 (к) | -379,1 | -318,9 | 189,5 |
| Br2 (г) | 30,92 | 3,14 | 345,35 |
| HBr (г) | -36,23 | -53,22 | 198,48 |
| C (алмаз) | 1,897 | 2,866 | 2,38 |
| C(графит) | 5,74 | ||
| CO (г) | -110,5 | -137,27 | 197,4 |
| CO2 (г) | -393,51 | -394,38 | 213,6 |
| COCl2 (г) | -223,0 | -210,5 | 289,2 |
| CS2(г) | 115,3 | 65,1 | 237,8 |
| CS2 (ж) | 87,8 | 63,6 | 151,0 |
| C2H2 (г) | 226,75 | 209,2 | 200,8 |
| C2H4 (г) | 52,28 | 68,12 | 219,4 |
| CH4 (г) | -74,85 | -50,79 | 186,19 |
| C2H6 (г) | -847,67 | -32,89 | 229,5 |
| C6H6 (г) | 49,04 | 124,50 | 173,2 |
| CH3OH (ж) | -238,7 | -166,31 | 126,7 |
| C2H5OH (ж) | -227,6 | -174,77 | 160,7 |
| CH3COOH (ж) | -484,9 | -392,46 | 159,8 |
| Ca (к) | 41,62 | ||
| CaO (к) | -635,1 | -604,2 | 39,7 |
| CaF2 (к) | -1214,0 | -1161,9 | 68,87 |
| CaCl2 (к) | -785,8 | -750,2 | 113,8 |
| CaC2 (к) | -62,7 | -67,8 | 70,3 |
| Ca3N2 (к) | -431,8 | -368,6 | 104,6 |
| Ca(OH)2 (к) | -986,2 | -896,76 | 83,4 |
| CaSO4 (к) | -1424,0 | -1320,3 | 106,7 |
| СaSiO3 (к) | -1579,0 | -1495,4 | 87,45 |
| Ca3(PO4)2 (к) | -4125,0 | -3899,5 | 240,9 |
| CaCO3 (к) | -1206,0 | -1128,8 | 92,9 |
| Cl2 (г) | 223,0 | ||
| HCl (г) | -92,30 | -95,27 | 186,7 |
| HCl (ж) | -167,5 | -131,2 | 55,2 |
| HClO (ж) | -116,4 | -80,0 | 129,7 |
| Cr (к) | 23,76 | ||
| Cr2O3 (к) | -1141,0 | -1046,84 | 81,1 |
| Cr(CO)6 (к) | -1075,62 | -982,0 | 359,4 |
| Cs (к) | 84,35 | ||
| Cs2O (к) | -317,6 | -274,5 | 123,8 |
| CsOH (к) | -406,5 | -355,2 | 77,8 |
| Cu (к) | 33,3 | ||
| Cu2O (к) | -167,36 | -146,36 | 93,93 |
| CuO (к) | -165,3 | -127,19 | 42,64 |
| Cu(OH)2 (к) | -443,9 | -356,90 | 79,50 |
| CuF2 (к) | -530,9 | -485,3 | 84,5 |
| CuCl2 (к) | -205,9 | -166,1 | 113,0 |
| CuBr2 (к) | -141,42 | -126,78 | 142,34 |
| CuI2 (к) | -21,34 | -23,85 | 159,0 |
| Cu2S (к) | -82,01 | -86,19 | 119,24 |
| CuS (к) | -48,5 | -48,95 | 66,5 |
| CuSO4 (к) | -771,1 | -661,91 | 113,3 |
| CuCO3(к) | -594,96 | -517398 | 87,9 |
| Cu(NO3)2 (к) | -307,11 | -114,22 | 193,3 |
| Fe(к) | 27,15 | ||
| FeO (к) | -263,68 | -244,35 | 58,79 |
| FeCl2 (к) | -341,0 | -302,08 | 119,66 |
| Fe2O3 (к) | -821,32 | -740,99 | 89,96 |
| Fe(OH)3 (к) | -824,25 | -694,54 | 96,23 |
| FeCl3 (к) | -405,0 | -336,39 | 130,1 |
| FeSO4 (к) | -922,57 | -829,69 | 107,51 |
| FeCO3 (к) | -744,75 | -637,88 | 92,9 |
| GeO (к) | -305,4 | -276,1 | 50,2 |
| GeO2 (к) | -539,74 | -531,4 | 52,30 |
| H2 (г) | 130,6 | ||
| H2O (г) | -241,84 | -228,8 | 188,74 |
| H2O (ж) | -285,84 | -237,5 | 69,96 |
| H2O2 (ж) | -187,36 | -117,57 | 105,86 |
| Hg (к) | 76,1 | ||
| HgCl (к) | -230,12 | -185,77 | 144,35 |
| Hg2Cl2 (к) | -264,85 | -210,66 | 195,81 |
| I2 (к) | 116,73 | ||
| I2 (г) | 62,24 | 19,4 | 260,58 |
| HI (г) | 25,94 | 1,30 | 206,33 |
| HIO (ж) | -158,9 | -98,7 | 24,32 |
| K (к) | 64,35 | ||
| K2O (к) | -361,5 | -193,3 | 87,0 |
| K2O (к) | -361,5 | -193,3 | 87,0 |
| KOH (к) | -425,93 | -374,47 | 59,41 |
| KNO3 (к) | -492,71 | -393,13 | 132,93 |
| KNO2 (к) | -370,28 | 281,58 | 117,15 |
| K2SO4 (к) | -1433,44 | -1316,37 | 175,73 |
| KHSO4 (ж) | -1158,1 | -1043,49 | 187,89 |
| KH (к) | -56,9 | -38,49 | 67,95 |
| Li (к) | 28,03 | ||
| Li2O (к) | -595,8 | -560,2 | 37,9 |
| LiOH (к) | -487,8 | -443,1 | 42,81 |
| Mg (к) | 32,55 | ||
| MgO (к) | -601,24 | -569,6 | 26,94 |
| Mg(OH)2 (к) | -924,66 | -833,7 | 63,14 |
| MgCO3 (к) | -1096,21 | -1029,3 | 65,69 |
| MnSO4 (к) | -1063,74 | -955,96 | 112,13 |
| N2 (г) | 191,5 | ||
| N2O(г) | 81,55 | 103,6 | 220,0 |
| NO (г) | 90,37 | 86,69 | 210,62 |
| NO2 (г) | 33,89 | 51,84 | 240,45 |
| N2O4 (г) | 9,37 | 98,29 | 304,3 |
| NH3 (г) | -46,19 | -16,64 | 192,5 |
| HNO3 (ж) | -173,0 | -79,91 | 156,16 |
| NH4Cl (к) | -315,39 | -343,64 | 94,56 |
| NH4OH (ж) | -366,69 | -263,8 | 179,9 |
| Na(к) | 51,42 | ||
| Na2O (к) | -430,6 | -376,6 | 71,1 |
| NaOH (к) | -426,6 | -377,0 | 64,18 |
| NaCl (к) | -410,9 | -384,0 | 72,36 |
| Na2CO3 (к) | -1129,0 | -1047,7 | 136,0 |
| Na2SO4 (к) | -1384,00 | -1266,8 | 149,4 |
| Na2SiO3 (к) | -1518,0 | -1426,7 | 113,8 |
| O2 (г) | 205,03 | ||
| P (красный) | -18,41 | -13,81 | 22,8 |
| PCl3 (г) | -277,0 | -286,27 | 311,7 |
| PCl5 (г) | -369,45 | -324,55 | 362,9 |
| HPO3 (ж) | -982,4 | -902,91 | 150,6 |
| H3PO4 (ж) | -1271,94 | -1147,25 | 200,83 |
| Pb(к) | 64,9 | ||
| PbO (к) | -217,86 | -188,49 | 67,4 |
| PbO2 (к) | -276,6 | -218,99 | 76,44 |
| PbCl2 (к) | -359,2 | -313,97 | 136,4 |
| PbSO4 (к) | -918,1 | -811,24 | 147,28 |
| PbS (к) | -94,28 | -92,68 | 91,20 |
| Rb (к) | 76,2 | ||
| Rb2O (к) | -330,12 | -290,79 | 109,6 |
| RbOH (к) | -413,8 | -364,43 | 70,7 |
| S (ромб) | 31,88 | ||
| SO2 (г) | -296,9 | -300,37 | 248,1 |
| SO3 (г) | -395,2 | -370,37 | 256,23 |
| H2S (г) | -20,15 | -33,02 | 205,64 |
| H2S (ж) | -39,33 | -27,36 | 122,2 |
| H2SO4 (ж) | -811,3 | -742,0 | 156,9 |
| H2Se (г) | 85,77 | 71,13 | 221,3 |
| SiO2 (к) | -859,3 | -803,75 | 42,09 |
| SnO(к) | -286,0 | -257,32 | 56,74 |
| SnO2 (к) | -580,8 | -519,65 | 52,34 |
| SrO (к) | -590,4 | -559,8 | 54,4 |
| SrCO3 (к) | -1221,3 | -1137,6 | 97,1 |
| H2Te (г) | 154,39 | 138,48 | 234,3 |
| Zn (к) | 41,59 | ||
| ZnO (к) | -394,0 | -318,19 | 43,5 |
| ZnS (к) | -201,0 | -198,32 | 57,7 |
| ZnSO4 (к) | -378,2 | -871,57 | 124,6 |
ОГЛАВЛЕНИЕ
| ПРЕДИСЛОВИЕ | |
| ВВЕДЕНИЕ | |
| 1.ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ В ХИМИИ | |
| 1.1. Основные химические понятия | |
| 1.2 Закон эквивалентов. Понятие эквивалент. Молярная масса эквивалента | |
| 1.3 Законы газового состояния. Определение молярных масс газообразных веществ | |
| 2. СТРОЕНИЕ АТОМА И ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И.МЕНДЕЛЕЕВА | |
| 2.1. Этапы на пути создания квантовой механики | |
| 2.2. Элементы квантово-механической теории атома | |
| 2.3. Некоторые свойства свободных и связанных атомов | |
| 3. ТИПЫ ХИМИЧЕСКОЙ СВЯЗИ | |
| 3.1. Ковалентная связь. Метод валентных связей | |
| 3.2. Ионная связь | |
| 3.3. Металлическая связь | |
| 3.4. Водородная связь | |
| 3.5. Молекулярное взаимодействие | |
| 4. ОБЩИЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ И ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ | |
| 4.1. Энергетика химических превращений | |
| 4.1.1. Термохимия. Закон Гесса | |
| 4.1.2. Энтропия | |
| 4.1.3. Энергия Гиббса и направленность химических процессов | |
| 4.2. Химическая кинетика | |
| 4.2.1. Скорость химической реакции | |
| 4.2.2. Физические методы стимулирования химических превращений | |
| 4.2.3. Катализ | |
| 4.3. Химическое равновесие | |
| 4.3.1. Константа химического равновесия | |
| 4.3.2. Принцип Ле Шателье | |
| 5. ДИСПЕРСНЫЕ СИСТЕМЫ | |
| 5.1. Способы выражения концентрации растворов | |
| 5.2. Свойства разбавленных растворов | |
| 5.3 Растворы электролитов | |
| 5.4. Ионное произведение воды. Водородный показатель | |
| 5.5 Равновесие в гетерогенных системах, произведение растворимости | |
| 6. ГИДРОЛИЗ СОЛЕЙ | |
| 6.1. Произведение растворимости. Примеры решения задач | |
| 7. ЖЕСТКОСТЬ ВОДЫ | |
| 8. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ | |
| 8.1 Электродные потенциалы и электродвижущие силы | |
| 8.2 Электролиз | |
| 8.3Коррозия металлов | |
| 9. КРИСТАЛЛИЧЕСКОЕ СОСТОЯНИЕ | |
| 9.1.Основные понятия | |
| 9.2 Симметрия кристаллов. Система кристаллов | |
| 9.3 Кристаллические решетки | |
| 10. СПЛАВЫ | |
| 10.1 Диаграммы состояния металлических систем | |
| ПРИЛОЖЕНИЯ | |
| БИБЛИОГРАФИЧЕСКИЙ СПИСОК |
Дата добавления: 2014-12-24; просмотров: 1503;
