Электролиз
Пример 1.Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 ч. при силе тока 4А?
Решение. Согласно законам Фарадея
m = ЭIt/96500, (1)
где т — масса вещества, окисленного или восстановленного на электроде; Э — молярная масса эквивалента вещества; I — сила тока, A; t — продолжительность электролиза, с.
Молярная масса эквивалентов меди в CuSO4 равна 63,54 : 2 = =31,77 г/моль. Подставив в формулу (1) значения Э = 31,77, I = 4 А, t= 60 ∙ 60 = 3600 с, получим
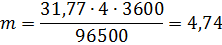
Пример 2.Вычислите молярную массу эквивалента металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880 Кл электричества и на катоде выделяется 11,742 г металла.
Решение. Подставляя в формулу (1) числовые значения, получаем
Э = 11,742 ∙ 96500/3880 = 29,35 г/моль,
где m = 11,742 г; It = Q = 3880 Кл.
Пример 3.Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода (н.у.)?
Решение. Из формулы (1)
I = m 96500/Эt
Так как дан объем водорода, то отношение т/Э заменяем отношением VH; /VЭ(Н  ), где VH
), где VH  — объем водорода, л.; VЭ(Н
— объем водорода, л.; VЭ(Н  ) объем эквивалентной массы водорода, л. Тогда
) объем эквивалентной массы водорода, л. Тогда
I = VH 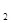 96500/ VЭ(Н
96500/ VЭ(Н 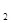 ).
).
Объем эквивалентной массы водорода при н.у. равен половине молярного объема 22,4/2 = 11,2 л. Подставив в приведенную формулу значения VН 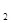 = 1,4 л, VЭ(Н
= 1,4 л, VЭ(Н 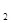 ) = 11,2 л, t = 6025 (1 ч 40 мин 25 с=6025 с), находим
) = 11,2 л, t = 6025 (1 ч 40 мин 25 с=6025 с), находим
I = 1,4∙96,500/(11.2∙6025) = 2А
Пример 4.Какая масса гидроксида калия образовалась у катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 л кислорода (н.у.)?
Решение. Объем эквивалентной массы кислорода (н.у.) 22,4/4 = = 5,6 л. Следовательно, 11,2 л содержат две молярные массы эквивалента кислорода. Столько же эквивалентных масс КОН образовалось у катода, или 56,11 ∙ 2 = 112,22 г (56,11 г/моль — молярная и эквивалентная масса КОН).
8.3.Коррозия металлов
При решении задач этого раздела см. табл. 8.
Коррозия — это самопроизвольно протекающий процесс разрушения металлов в результате их химического или электрохимического взаимодействия с окружающей средой.
При электрохимической коррозии на поверхности металлаодновременно протекают два процесса: анодный — окисление металла
Ме°-пе=Меп+ и катодный — восстановление ионов водорода
2Н+ + 2е = Н2
или молекул кислорода, растворенного в воде,
О2 + 2Н2О + 4е- = 4ОН-
Ионы или молекулы, которые восстанавливаются на катоде, называют деполяризаторами. При атмосферной коррозии — коррозии во влажном воздухе при комнатной температуре — деполяризатором является кислород [1].
Пример 1.Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном и кислом растворах? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение. Цинк имеет более отрицательный потенциал (-0,763 В), чем кадмий (-0,403 В), поэтому он является анодом, а кадмий катодом.
Анодный процесс:
Zn°-2e-=Zn2+ катодный процесс:
в кислой среде 2Н+ + 2е- = Н2
в нейтральной среде ½ О2 + Н2О + 2е- = 2ОН-
Так как ионы Zn2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2.
Дата добавления: 2014-12-24; просмотров: 4153;
