Получение хлората калия электролизом(с фотками), для новичков
Получение хлората калия
Краткое объяснение всех стадий изготовления:
На самом деле получение хлоратов это не такое уж сложное дело как кажется, просто надо соблюдать все правила и делать все по инструкции.
Для изготовления хлората нам понадобится:
• блок питания на 5 вольт 2 ампер и выше
• графитовые электроды(палки)
• поваренная соль(хлорид натрия) NaCl
• Хлорид калия KCl/гидроксид калия KOH(лучше хлорид)
• Соляная кислота 5% раствор
• Гидроксид натрия NaOH
• PH Бумага(измерять PH)
• стаканы, воронка, мерный стакан, бумажный фильтр и т.д.
В приготовление хлората есть три стадии:
1. Приготовления электролита где мы растворяем и очищаем соль NaCl
2. Сам электролиз который превращает с хлорида в хлорат при помощи тока NaCl => NaCl+NaClO+NaClO2+NaClO3
3. На этой стадии мы очищаем электролит от примесей и превращаем в хлорат NaCl+NaClO+NaClO2+NaClO3 (+100 градусов по Цельсию)=>NaCl+NaClO3(NaClO=NaCl+NaClO3), NaClO3+NaCl+KOH / KCl =KClO3+NaCl +NaCl / NaOH).
Ну вот и все, теперь перейдем к каждой стадии и объясним её более подробно.
I-приготовление электролита:
Растворяем хлорид натрия(обычную поваренную соль) в воде её растворимость 35 грамм на 100мл воды. Соль желательно очистить от всяких примесей так что растворяем в 100 мл воды 40 грамм соли, кипятим и охлаждаем до комнатной температуры потом процеживаем чистый раствор от того что выпало.
Я растворяю сразу на 2 банки электролиза в каждой по 250мл, те мне надо 500мл раствора и 175 грамм соли(NaCl)
Я все высыпаю в сосуд и начинаю греть на огне:


Потом когда вся соль растворилась я охлаждаю и процеживаю от осадка который не растворился:
Вот мой окончательный раствор NaCl

На этом стадия приготовления начального раствора закончена, и мы переходим к:
II-приготовление электролизера ( подсчет время электролиза):
Ведение:
Изготовления электролиза это не самая сложная работа! Наверное самое трудное и самая дорогая вещь тут это блок питания а именно нам нужен мощный который превышает 2 ампер а лучше использовать на 10-15-20 ампер а они довольно дорого стоят.
Ампераж имеет большое значение в электролизе! Он имеет прямое отношения к скорости электролиза чем ампераж выше тем время электролиза меньше! Но стоит помнить важное правила, чтоб не было утечек хлора которые ведут к маленькому выходу хлоратов нельзя допускать повышения 2 ампера на 100 мл.
Для производства хлоратов нужно около 3 вольт если не считать что половину расходуется из-за сопротивления электролита и проводов! Так что надо ставить около 3.5-4.5 вольт для производство хлоратов если давать больше вольт то они будут переходить в теплоту а нам надо помнить что выше 40 градусов желательно чтоб температура не поднималась так как при повышение температуры коррозия электродов увеличивается (другими словами графитовые электроды начинают сыпаться...)
Так же если вы используете блок питания без охлаждения и вы перегружаете его(это заметно через пол часа, час электролиза, если он начинает нагреваться то вам нужно на него поставить охлаждения(прицепить вентилятор) а то в конце он может просто напросто сгореть!
Обычно используют блок питания для подзарядки автомобильных аккумуляторов они довольно не плохо подходят как блок питания для электролиза только вот единственная проблема что они выдают 12 вольт! А для одного электролиза это слишком много! Так что обычно ставят сразу 2 банки электролиза и отключают их вместе так что получается на каждый по 6 вольт, а это вполне нормально!
Не малую роль играют сами электроды в электролизе! Анод а он (+) обязан быть из стойкого материала например графит, а лучше поставить и анод и катод из графита(хотя катод можно сделать просто из куска железа, обычного гвоздя)!
Банка электролиза желательно должна быть из стекла, так же не забыть сделать в крышке дырку для трубки чтоб хлор мог выходить на улицу и не попадал в комнату(хлор довольно ядовитый газ так что лучше задуматься над его отводом на улицу).
Ну вот и вкратце об электролизе как все должно быть!
Скорость получения продукта:
Так же важно подсчитать через сколько времени электролиз полностью превратит весь хлорид в хлорат...
Время превращения хлорида в хлорат зависит от тока и эффективности. Эффективность электролизеров сильно варьируется, поэтому точное время производства рассчитать не представляется возможным. Тем не менее полагая эффективность равной 100%, время производство можно вычислить примерно. Как показано в теории, при оптимальном пути процесса для образования 1 моль хлората требуется 6 фарадей заряда. Один фарадей - заряд соответствующий одному молю электронов, то есть произведение заряда электрона на число Авогадро: (1,6*10-19)* (6,03*1023) = 96480 Kл, поскольку 1А соответствует протеканию одного кулона в секунду, то один фарадей соответствует 96480/3600 = 26,8 A*ч. В нашем случае для производства одного моля хлората требуется 6 фарадей, т.е 160,8 ампер-часов (АЧ). Так к примеру если электролизер содержит 100 грамм хлорида натрия и эффективность полагается 100%-ной, то для преобразования потребуется : (100/58,6)*160,8 = 274,4 АЧ. А если к примеру, через электролит протекает ток силой 3 ампера, то на преобразование потребуется 274,4 / 3 = 91,47 часа (91 час 28 мин).
Изготовление банки электролиза(и самых электродов):
Нам понадобится 2 одинаковый банки желательно стеклянные и желательно с крышкой который плотно закрывается! У меня есть подходящие банки по 250 мл каждая из под меда или варенья:

Делаете в крышке 3 дырки одну дырку для электрода делаете чуть больше, потому как крышка железная и нам придется на один из электродов намотать резинку или налить какой-то пластик чтоб не замкнула.

Изготовление электрод:
Покупаем в магазине графитовые электрода для сварки(они покрыты тонким слоем меди) вот так они выглядят:

Мы его распиливаем по полам:

Дальше начинам обрабатывать (снимать медь с графита) лучше всего это сделать при помощи азотки (HNO3)
Подготавливаем раствор азотки...

Затем медленно опускаем в азотку наш электрод:

Вот так выглядят электроды после обработки:

Затем вставляем электроды в крышку где мы заранее сделали дырки, по следующей схеме:
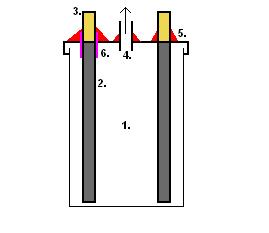
1. Банка электролиза
2. Сами электрода(графит)
3. Электроды сверху(покрытия медь) для того чтоб потом туда припаять провод
4. газо-отводная трубка(если электролиз герметичен то требуется газоотводная трубка для того чтоб выходил хлор.
5. герметичный клей! После того как мы вставляем электроды мы заклеиваем (хороший стойкий к темп. Клей) для того чтоб у нас была герметичная банка...
6. Это резинка которые одевается на один из электродов(в случае если у вас пластмассовая крышка то вам это не понадобится ) если крышка все же железная то нужна как то изолировать один из электродов для того чтоб не произошло замыкания. Лучше всего для этого дела подходит трубочка который при темп. Сжимается , её можно купить в магазине по электроники
Вот фотка моего электролиза! Там хорошо видно клей, видно газоотводную трубку, так же если присмотреться видно графитовые электроды через стеклянную банку а сверху медное покрытие и видно на (+) красную резинку чтоб электроды не замыкали с друг другом!

Затем герметизируем банку электролиза тонкой лентой для инсталляции (для водопроводный труб)

Затем припаиваем провода к электродам:

Наливаем в банки наш обработанный раствор NaCl
Ставим 2 банки в воду(если они греются) все подключаем как было описано сверху и включаем.

Включаем блок питания и видим как с двух электродов выделяется газ хлор

Ну вот мой электролиз

III-Обработка раствора:
После того как прошло определенное количество времени и вы отключили ваш электролиз то раствор не обходима очистить в несколько стадиях.
1. Во-первых в растворе присутствует разные крупные частицы(куски графита и тд) их легко удалить если процедить раствор через фильтр.
После того как вы процедили раствор вам не обходимо избавится от промежуточных стадиях электролиза.
А это NaClO/NaClO2
2. Берем наш раствор и кипятим в течение 10 мин,
| <== предыдущая лекция | | | следующая лекция ==> |
| | | Код раздела :1 |
Дата добавления: 2014-12-08; просмотров: 9271;
