Кристаллические решетки
Зонке (1879 г.), Чермак, Шенфлис, Федоров (1891 г.) и другие показали геометрически, что все кристаллические формы можно представить как результат распределения точек (мельчайших вещественных частиц) в пространстве по законам симметрии; получающиеся конфигурации они назвали кристаллическими решетками.
Распределяя согласно элементам симметрии точки в пространстве, они получили 230 комбинаций, 230 кристаллических решеток, которые соответствуют всем встречающимся в природе кристаллическим формам.
Последующее исследование кристаллов с помощью лучей Рентгена немецким ученым Лауэ (1912 г.) подтвердило те предположения и выводы, которые были сделаны косвенным путем. Были получены прямые доказательства существования атомов, ионов и способов их расположения в пространстве.

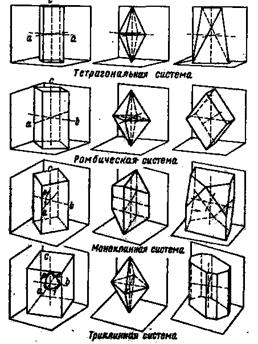
Рис.6. Схематическое изображение осей кристаллов и граней
Кристаллические решетки, как выяснилось, делятся на следующие группы: атомные, ионные, молекулярные и металлические.
Атомные решетки. Каждое узловое место в атомной решетке занято нейтральным атомом. Примером может служить кристаллическая решетка аргона, приведенная на рисунке 7.
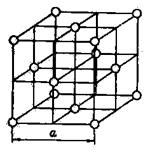
Рис. 7. Кристаллическая решетка аргона
Ионные решетки. Каждое узловое место в ионной решетке занято ионом. Примеры ионных решеток приведены на рисунках 8 и 9. На рис. 8, а показана кристаллическая решетка Na+Cl-, на рис. 8,6 — решетка CsJ; на рис. 9 приведена кристаллическая решетка CaF2.
Кристаллическая решетка Na+Cl- типична для бинарных электролитов, состоит из двух центрированных в гранях решеток, вдвинутых одна в другую на ½ длины ребра куба. Одна решетка — катиона Na+, другая такая же—аниона С1-.

Рис. 8. Кристаллическая решетка NaCl и CsJ
Кристаллическая решетка Cs+J- представляет собой сочетание двух простых кубических решеток: решетки иона Cs+ и решетки иона J-, вдвинутых одна в другую так, что в центре куба находится ион йода, а в углах — ионы Cs+. Эта решетка центрирована в пространстве так, что в центре куба находится анион, а в углах —катионы.
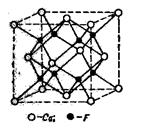
Рис. 9. Кристаллическая решетка CaF2
Кристаллическая решетка Ca2+F2- типична для многих тройных электролитов. Здесь ионы Са2+ образуют кристаллическую, центрированную в гранях, решетку, ионы же F- расположены в серединах восьми маленьких кубов, на которые может быть разложен большой куб.
В ионных кристаллических решетках отдельные места могут занимать сложные и комплексные ионы. Примеры: решетка нитрата натрия Na+NO3- (pис 9, а) и решетка гексахлороплатината калия K+[PtCl6]2- (рис. 10,б). Здесь отдельные места занимают ионы: Na+, К+, NO3-, [PtCl6]2-.
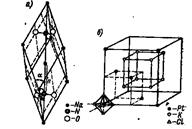
Рис. 10. Кристаллическая решетка нитрата натрия и гексахлороплатината калия.
В кристаллической решетке нитрата натрия каждый ион NO3- занимает одно место, причем в центре тетраэдра — атом азота N+5, а в углах — атомы кислорода О; атомы сближены друг с другом и составляют прочную, крепко стянутую группу.
Такую же группу представляет собой прочный комплексный ион [PtCl6]2- . Пространственно он построен так: в центре октаэдра — ион Pt4+, а в углах — ионы С1-.
Ионы [PtCl6]2- занимают углы кубической, центрированной в гранях, кристаллической решетки. Ионы К+ составляют куб.
Молекулярные решетки. В молекулярных решетках отдельные места занимают молекулы. Примером молекулярных решеток соединений, которые рассматриваются в неорганической химии, могут служить кристаллические решетки окиси алюминия (рис. 11, а) и двуокиси углерода СО2 (рис. 11,6). В кристаллической решетке окиси алюминия Аl2Оз углы ромба с длиной ребра αo = 5,12А занимают близко расположенные друг к другу группы атомов, образующие нейтральную молекулу.
В кристаллической, центрированной в гранях, решетке двуокиси углерода отдельные места занимают нейтральные молекулы СО2, очень сближенные группы из трех атомов С и 2О, сгруппированные так, как это показано на рис.11.
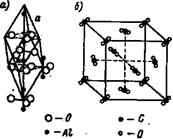
Рис. 11. Кристаллическая решетка окиси алюминия и двуокиси углерода СО2
Металлические решетки. Металлические решетки характеризуются особыми свойствами, отличающими их от других типов кристаллических решеток. В узлах металлических решеток находятся не атомы, а положительные ионы. Внешние электроны атомов металлов свободно мигрируют внутри кристаллической решетки, переходя от одного иона к другому, т. е. ведут себя подобно молекулам газа, поэтому всю совокупность электронов в кристаллической решетке металлов называют электронным газом.
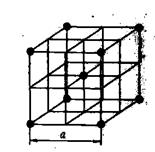
Рис. 12. Кристаллическая решетка металлического натрия
Таким образом, металлическую решетку можно рассматривать как ионную решетку, находящуюся в «атмосфере» электронного газа из внешних электронов. Такова, например, решетка металлического натрия (рис. 12). Характерные свойства металлов — электропроводность и теплопроводность, в частности, зависят от передвижения электронов внутри решетки. Под воздействием внешнего электрического поля валентные электроны, число которых у атомов металлов невелико (1, 2 или 3), перемещаются в направлении поля, создавая электрическую проводимость.
Дата добавления: 2014-12-24; просмотров: 3061;
