Хлорный электролиз
Задача 12
Определите объем Cl2, выделившийся при электролизе водного раствора NaCl на платиновых электродах, если объем выделившегося при этом Н2 44,8 мл. Выход по току хлора – 80%.
Решение.
Ионный состав раствора:
NaCl → Na+ + 2l- рН =7 гидролизa соли нет
H2O ↔ H+ + OH-
Потенциалы возможных процессов:
ЕрН+/Н2 = -0,059рН = -0,41В
ЕрО2/ОН- =1,23-0,059рН = +0,81В;
Е0Сl2/Cl- = + 1,36В
Е0Сl2/Cl- - ЕрО2/ОН- < 1 Þ возможны оба процесса
Электродные процессы:
[- K]: 2Н+ + 2е → Н2↑
[+A]: 4ОН- → О2 ↑ + 2Н2О + 4е
2Cl- → Cl2 + 2e
По закону Фарадея:
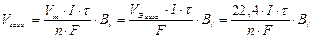
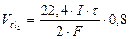
Количество электричества, прошедшее через электроды: qk = qa =I·τ
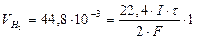 Þ
Þ 
Þ 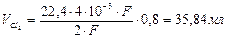
Дата добавления: 2014-12-03; просмотров: 1002;
