Внутренняя энергия и теплоемкости идеального газа
Внутренняяэнергиягаза складывается из энергии отдельных молекул. В одном киломоле любого газа содержится NА молекул (NА--число Авогадро ). Следовательно, один киломоль идеального газа имеет внутреннюю энергию, равную
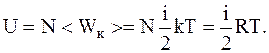
Внутренняя энергия произвольной массы газа m:
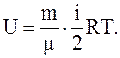
где m – молярная масса газа.
Удельной теплоёмкостью "c" газа называется физическая величина, численно равнаяколичеству теплоты, которое необходимо сообщить единице массы газа для нагревания её на один градус.
Молярной теплоёмкостью " C " называется физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю газа, чтобы увеличить его температуру на один градус.
Связь между удельной и молярной теплоемкостями:
C=mc.
Молярная теплоёмкость при постоянном объёме "Cv" – физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю газа, чтобы увеличить его температуру на один градус в условиях постоянного объема.
Молярная теплоёмкость при постоянном давлении "Cp" – физическая величина, численно равная количеству теплоты, которое необходимо сообщить одному молю газа, чтобы увеличить его температуру на один градус в условиях постоянного давления.
Если газ нагревается при постоянном объёме, то подводимое к газу тепло идётна увеличение его внутренней энергии. Следовательно, в этом случае изменение внутренней энергии газа принагревании его на один градус будет равно молярнойтеплоёмкости
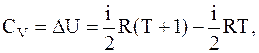
т.е.
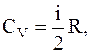 а
а 
При нагревании одного молягаза в условияхпостоянного давления сообщаемое ему извне тепло идёт не только на увеличение его внутренней энергии, но и на совершение работы против внешних сил.
Следовательно
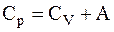
Работа, совершаемая по расширению одного моля газа, в условиях постоянного давления
A=R,
где R – универсальная газовая постоянная.
Следовательно
Cp=Cv+R,
а
cp=cv+R/m.
Окончательно
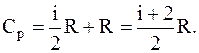
а
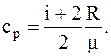
Отношение
Сp/Сv=g;
g=Cp/Cv=cp/cv; g=(i+2)/i.
Дата добавления: 2014-12-30; просмотров: 3029;
