Функции распределения
Согласно молекулярно-кинетической теории молекулыидеального газа находятся в непрерывном хаотическом движении с равномерным распределением по направлениям.
Скорости молекул при этом изменяются по величине. Наиболее близкой к истинному значению скорости является средняя квадратичная скорость молекул, которая для газа массой "m" находящегося в состоянии равновесия при T=const остаётся постоянной:

Статистический закон Максвелла указывает на существование некоторой наиболее вероятной скорости движения молекул, в окрестности которой в интервале v, v+dv находится большее число молекул, чем в окрестности другой скорости.
Максвелловский закон распределениямолекулидеального газапо скоростям в стационарном состоянии выражается формулой:
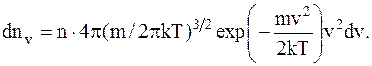
где dnv – среднее число молекул в единице объема со скоростями в интервале от v до v+dv;
n – число молекул в единице объема.
Откуда
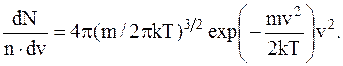
где dN/ndv – функция распределения, которая показывает, какая доля молекул от их общего числа отнесена к некоторому интервалу скоростей.
Для наиболее вероятной скорости движения молекул была получена формула:
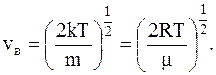
Кроме <vкв> и vв для описания движения молекул идеального газа вводится понятие средней арифметической скорости:

Для расчета числа молекул, движущихся со скоростями в интервале от v до v+dv, часто вводят понятие относительной скорости u=v/vв, тогда закон распределения Максвелла имеет вид:
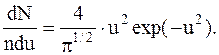
Атмосферное давление на какой-либовысоте обусловлено весом вышележащих слоев газа.
Если давление газа на высоте ho-po, а высоте h-p, то
p=po exp(-mgh/kT).
Данное соотношениеназывают барометрической формулой, которая показывает, чтодавление убывает с высотой тем быстрее, чем тяжелее газ и чем ниже его температура.
Заменив в барометрической формуле значениядавлений, на число молекул в единице объема получим
n=no exp(-mgh/kT).
но R=m/k, тогда
n=no exp(-mgh/RT).
Полученнаяформулаопределяет закон распределения молекул газа по высоте в поле сил тяготения.
Но mgh=Wp – потенциальная энергия молекул в поле сил тяготения, следовательно:
n=no×exp(-Wp/kT),
где no – число молекул в единице объема в том месте, где потенциальная энергия молекул равна нулю;
n – число молекул в единице объема в тех точках пространства, где потенциальная энергия молекул равна Wp.
Это распределение и называют распределением Больцмана, которое дает распределениечастиц по значениям потенциальной энергии.
Плотность газа в зависимости от высоты изменяется по закону:
r=ro×exp(-mogh/кТ),
где mo – масса одной молекулы.
Прямолинейные участки траектории, проходимые молекулой между двумя последовательнымисоударениями, называются свободными пробегами.
Средняя длина свободного пробега
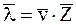 ,
,
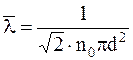 ,
,
где no – число молекул в единице объёма.
Среднее число соударений <Z>, численно равно отношению средней скорости движения молекул <v> и <l>:
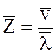 ;
;
 ,
,
где s – эффективное сечение.
Минимальное расстояние, на которое сближаются при столкновении центры 2-х молекул, называется эффективным сечением.
Используя основное уравнение кинетической теории газов p=nokT,
можно записать
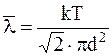 .
.
Средняя длина свободного пробега при какой-то температуре Т может быть определена по формуле:
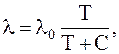
где C – постоянная Сезерленда, зависящая от интенсивности молекулярных взаимодействий;
lo – длина свободного пробега молекул без учёта их взаимодействий.
Дата добавления: 2014-12-30; просмотров: 2613;
