В связи с этим, для реальных газов, Ван-дер-Ваальс предложил
ввести две поправки в уравнение Менделеева- Клапейрона:
а) поправку на собственный объём молекул идеального газа «а»;
б) поправку на влияние сил межмолекулярного взаимодействия ("на внутреннее давление") «b».
С учётом этого уравнение состояния реального газа для моля имеет вид:
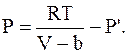
или
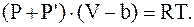
где P'=a/V2 – так называемое внутреннее давление.
Следовательно,
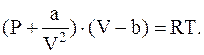
Для произвольной массы газа его можно записать в следующем виде:
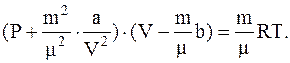
Внутренняя энергия одного моля реального газа равна
U=CVT-а/V.
При адиабатическом расширении газов, когда не происходит обмена теплом с окружающим пространством, внутренняя энергия реального газа не изменяется, т.е.
U1=U2,
При этом: а) в случае адиабатического расширения газ – нагревается; б) в случае адиабатического сжатия – охлаждается.
Изменение температуры реального газа при расширении через пористую перегородку называется эффектом Джоуля-Томсона.
Дата добавления: 2014-12-30; просмотров: 1409;
