Примеры решения задач. 1.4.1. В баллоне вместимостью V=8 л находится кислород массой m=0,3 кг при температуре T=300 К
1.4.1. В баллоне вместимостью V=8 л находится кислород массой m=0,3 кг при температуре T=300 К. Найти, какую часть вместимости сосуда составляет собственный объем молекул газа? Определить отношение внутреннего давления p' к давлению p газа на стенки сосуда.
Решение. Для получения ответа на первый вопрос задачи необходимо найти отношение
k=V'/V,
где V'-собственный объем молекул.
Собственный объем молекул найдем, воспользовавшисьпостоянной Ван-дер-Ваальса b, равной учетверенному объему молекул, содержащихся в одном моле реального газа. В уравнении Ван-дер-Ваальса:
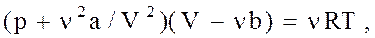
поправка nb означает учетверенный объем молекул всего газа, т.е.
nb=4V'.
Отсюда
V'=nb/4, или V'=mb/(4m),
где n=m/m-количество вещества;
m – молярная масса.
Подставив полученное значение V' в формулу для определения k, найдем:
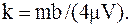
Для ответана второй вопрос задачинадо найти отношение
k=p'/p.
Как следует из уравнения Ван-дер-Ваальса
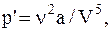 или
или 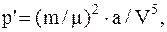
где a – постоянная Ван-дер-Ваальса для одного моля газа.
Давление p, производимое газом на стенки сосуда, найдем из уравнения Ван-дер-Ваальса
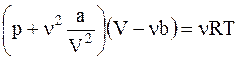 ;
;
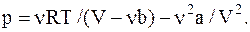
Проверив размерности полученных результатов, подставив численные значения в СИ, будем иметь:
k=0,91,
что означает – собственный объем молекул составляет 0,91 от объема сосуда;
p'=179 кПа,
p=2,84×106 Па,
k=6,3%.
Следовательно, давление газа, обусловленное силами притяжения молекул, составляет 6,3% давления газа на стенки сосуда.
1.4.2. Углекислый газ, содержащий количество вещества n=1 моль, находится в критическом состоянии. При изобарном нагревании газа его объем V увеличился в k=2 раза. Определить изменение DT температуры газа, если его критическая температура Ткр=304 К.
Решение. Для решения задачи удобно воспользоваться уравнением Ван дер Ваальса в приведенной форме, т.е. в такой форме, когда давление p, молярный объем Vm и температура T реального газа с соответствующими критическими параметрами представлены в виде следующих соотношений:
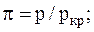
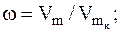
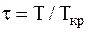 .
.
Из этих выражений получим:
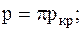
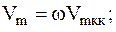
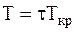 .
.
Подставив сюда выражения pкр, Vmкр, и Tкр через постоянные Ван дер Ваальса a и b, найдем:
p=ap/27b2 ; Vm=3bw ; T=8at/27bR.
Полученные выражения p, Vm и T подставим в обычное уравнение Ван дер Ваальса:
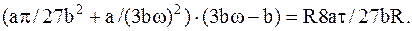
Дата добавления: 2014-12-30; просмотров: 3482;
