Кинетические основы газовых реакций.
По закону действующих масс скорость реакции при постоянной темпе-ратуре пропорциональна концентрации реагирующих веществ или, как гово-рят, «действующих масс».
Скоростью химической реакции (υ) принято считать количество веще-ства, реагирующего в единицу времени (dt) в единице объема (dV).
Рассмотрим реакцию, протекающую по уравнению:
А + В = С + Д.
Поскольку скорость реакции характеризует уменьшение во времени концентрации реагирующих веществ и увеличение концентрации продуктов реакции, то можно записать:
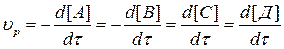 , (3.1)
, (3.1)
где минусы при производных говорят о направлении изменения концентра-ции компонентов, а в квадратных скобках указаны концентрации компонен-тов.
Тогда прямая необратимая реакция при Т = const протекает со скоро-стью:
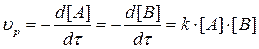 , (3.2)
, (3.2)
где: k – константа скорости химической реакции. Она не зависит от концентрации компонентов, а изменяется только с температурой.
По закону действующих масс концентрации компонентов реакции вхо-дят в кинетическое уравнение в степени, равной стехиометрическому коэф-фициенту этого компонента.
Так, для реакции
аА + bB = cC + dД
Кинетическое уравнение имеет вид:
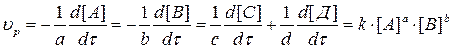 … (3.3)
… (3.3)
Показатели степеней a, b, c, d принято называть порядками реакции по компонентам А, В, С, Д, а сумму показателей – общим порядком реакции.
Например, реакции типа
А ® bB + cC – I порядка,
2А = bB + cC – II порядка,
А + B = cC + dД – III порядка.
Поскольку концентрации всех реагирующих компонентов связаны ме-жду собой стехиометрическими уравнениями, то простейшие кинетические уравнения I порядка являются дифференциальными уравнениями I порядка с одной независимой переменной – концентрацией – и могут быть проинтегри-рованы.
Простейшим кинетическим уравнением является уравнение I порядка типа
А=bB+cC…,
для которого 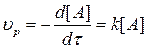 . (3.4)
. (3.4)
Обозначим через [A0] концентрацию компонента А до начала реакции и, проинтегрировав уравнение при граничном условии t=0, [А]=[А0], получа-ем:
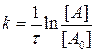 , или [A]=[A0]×e-kt. (3.5)
, или [A]=[A0]×e-kt. (3.5)
Таким образом, зависимость скорости реакции от концентрации ве-ществ имеет экспоненциальный характер.
Кинетическая энергия газов объясняет это так. По гипотезе Аррениуса реакция между молекулами проходит лишь в том случае, если они являются активными, т.е. обладают избыточной энергией, достаточной для разрыва межатомных связей, так называемой энергией активации ЕА.
Т.е. скорость химической реакции зависит не от количества столкнове-ний всех молекул, а только активированных.
По закону Больцмана, число активных молекул
nA = nо * e-E/RT, (3.6)
где: Е – энергия активации,
Т – температура газовой смеси,
nо – общее число молекул.
Тогда и число эффективных соударений, совпадающее со скоростью реакции, равно:
υр = Zэфф = Z0 * e-E/RT, (3.7)
где: Z0 – общее число соударений молекул.
Итак:
1) скорость реакции пропорциональна концентрации активных моле-кул, число которых зависит от температуры и давления в смеси, так как дав-ление и есть количество молекул, сталкивающихся с какой-либо поверхно-стью;
2) реакция возможна лишь в том случае, если взаимодействующие мо-лекулы получают определенный запас энергии, достаточный для разрыва или ослабления межатомных связей. Активация заключается в переходе молекул в такое состояние, в котором возможно химическое превращение.
Чаще всего процесс активации идет путем образования промежуточных неустойчивых, но высокоактивных соединений атомов.
Таким образом, не только для протекания эндотермических процессов нужен внешний подвод энергии, но и для экзотермических. Чтобы произош-ла экзотермическая реакция, надо сообщить ей какой-то импульс тепловой энергии. Например, для протекания реакции горения в смеси водорода с ки-слородом, надо ее поджечь.
Минимальное количество тепловой энергии, необходимое для «запус-ка» химической реакции, называется энергией активации.
Дата добавления: 2019-07-26; просмотров: 371;
