Свойства твердых веществ.
Сильный нагрев твердого тела приводит к плавлению и переходу в жидкое состояние, а затем при испарении – в газ. Ряд твердых веществ может непосредственно из твердой фазы перейти в газообразное. Такой процесс на-зывается сублимацией, или возгонкой.
Фазовые превращения определяются изменением температуры и давле-ния. Для объяснения фазовых переходов используется диаграмма состояния, показанная на рис. 6, на которой дается зависимость между температурой фа-зового перехода и давлением в виде кривых испарения (КИ), плавления (КП) и сублимации (КС), разделяющих поле диаграммы на три области, соответ-ствующие условиям существования твердой (ТТ), жидкой (Ж) и газообразной (Г) фаз. Кривые на диаграмме называются кривыми фазового равновесия. Каждая точка на них соответствует условиям равновесия двух сосуществую-щих фаз: КП – твердого тела и жидкости, КИ – жидкости и газа, КС – твердо-го тела и газа. Точка К – критическая точка.
Точка, в которой пересекаются все кривые и которая, следовательно, определяет условия ТТР и РТР одновременного равновесного состояния трех фаз, называется тройной точкой (mТР). Каждое вещество имеет только одну тройную точку.
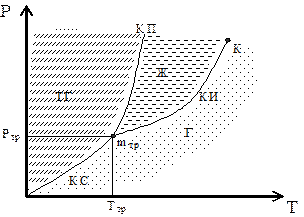
Рис. 6. Диаграмма состояния фаз в системе твердое тело – жидкость – газ.
Диаграмма состояния позволяет судить, в каком состоянии находится вещество при определенных Р и Т, а также какие фазовые переходы могут протекать при том или ином процессе.
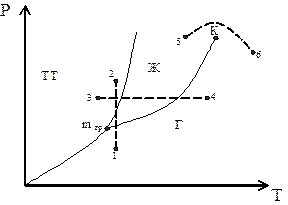
Рис. 7. Фазовые переходы в систе-
ме твердое тело – жидкость – газ.
Например (рис. 7): если вещество находится в точке 1, то при изотер-мическом сжатии оно проходит состояния жидкости и кристаллического (ли-ния 1-2); если вещество находится в т. 3, то при изобарном нагреве (линия 3-4), оно проходит состояния: твердое - жидкое и газ.
Из диаграммы видно, что кривая испарения заканчивается в критиче-ской точке К. Благодаря этому возможен непрерывный переход вещества из жидкого состояния в газообразное и обратно в обход точки К (переход 5-6) без пересечения кривой испарения, т.е. такой переход не сопровождается фа-зовыми превращениями.
Таким образом, плавление однокомпонентного вещества происходит при постоянной для данного давления температуре плавления. Количество теплоты, необходимое для расплавления единицы массы твердого тела, на-зывается удельной теплотой плавления ( 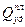 ). При повышении давления для большинства веществ температура плавления повышается. При конденсации паров и кристаллизации т.е. при Т<TИСП и Т<ТПЛ, теплота выделяется из ве-щества. Диаграмма состояния в координатах температура-время при P=const такова (рис. 8).
). При повышении давления для большинства веществ температура плавления повышается. При конденсации паров и кристаллизации т.е. при Т<TИСП и Т<ТПЛ, теплота выделяется из ве-щества. Диаграмма состояния в координатах температура-время при P=const такова (рис. 8).

Рис. 8. Термограмма состояния вещества.
Испарение и плавление твердых тел сопровождается поглощением теп-лоты испарения или плавления, затрачиваемой на преодоление связей между частицами и на отрыв частиц от поверхности кристаллов или жидкости.
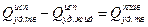 .
.
Температуры плавления твердых тел и кипения жидкостей различны и объясняются разными энергиями связей между атомами и молекулами ве-ществ.
Рассмотренные физические свойства веществ учитываются при разра-ботке, выборе и оценке эффективности огнетушащих средств и материалов.
Тема 3. ХИМИЧЕСКИЕ ОСНОВЫ ГОРЕНИЯ.
Дата добавления: 2019-07-26; просмотров: 346;
