Тепловой эффект реакции.
То, что в каждом индивидуальном веществе заключено определенное количество энергии, служит объяснением тепловых эффектов химических реакций.
По закону Гесса: Тепловой эффект химической реакции зависит только от природы начальных и конечных продуктов и не зависит от числа проме-жуточных реакций перехода от одного состояния к другому.
Следствие 1 этого закона: Тепловой эффект химической реакции равен разности между суммой теплот образования конечных продуктов и суммой теплот образования исходных веществ с учетом коэффициентов при форму-лах этих веществ в уравнении реакции.
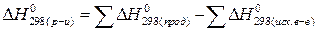 .
.
Например, в реакции 2Н2+О2=2Н2О±DН.
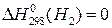 ;
; 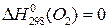 ;
; 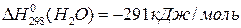 .
.
Тогда:
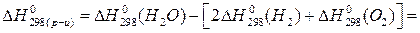
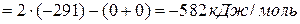 .
.
В итоге общее уравнение реакции будет выглядеть так:
2Н2+О2=2Н2О – 582 кДж/моль.
И если DН со знаком (-), то реакция экзотермическая.
Следствие 2. По закону Лавуазье-Лапласа тепловой эффект разложе-ния химического соединения равен и противоположен по знаку тепловому эффекту его образования.
Тогда реакция разложения воды будет:
2Н2О=2Н2+О2+582 кДж/моль, т.е. эта реакция эндотермическая.
Пример более сложной реакции:
СН4+2О2=СО2+2Н2О.
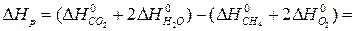
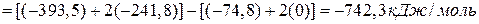 .
.
Тогда реакция запишется так:
СН4 + 2О2 = СО2 + 2Н2О – 742,3 кДж/моль, значит реакция экзотермиче-ская.
Дата добавления: 2019-07-26; просмотров: 362;
