Энергия активации реакции.
Для объяснения данного явления часто пользуются следующим приме-ром (рис. 9):
На площадке лежит шар. Площадка расположена перед горкой. Поэто-му шар мог бы скатиться сам вниз, если бы не горка. Но для самопроизволь-ного спуска его надо поднять на вершину горки. При этом освободится не только энергия подъема на горку, но и энергия спуска вниз.
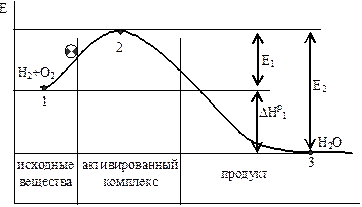
Рис. 9. Схема активирования реакции.
Рассмотрим две реакции:
1) Н2+О2=Н2О- 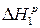
2) Н2О=Н2+О2+ 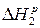
Как видно из рисунка, Е2= 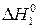 +Е1;
+Е1;
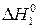 =Е2 - Е1;
=Е2 - Е1;
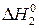 =Е1.
=Е1.
В общем, при любой реакции
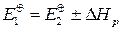 .
.
И от разности Е1 и Е2, которые всегда положительные, зависит знак те-плового эффекта.
Таким образом, энергия активации – это энергия, необходимая для пре-вращения реагирующих веществ в состояние активного комплекса (разрыв межатомных связей, сближение молекул, накопление энергии в молекуле…).
С повышением температуры газов резко увеличивается доля активных молекул (е-Е/RT), а значит скорость реакции по экспоненциальной зависимо-сти. Эту зависимость можно проиллюстрировать следующим образом:
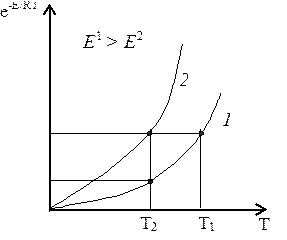
 Рис. 10. Зависимость скорости реак-ции от температуры: 1 – скорость 1-ой реакции, 2 – скорость 2-ой реак-ции.
Рис. 10. Зависимость скорости реак-ции от температуры: 1 – скорость 1-ой реакции, 2 – скорость 2-ой реак-ции.
Как видно из рисунка 10, скорость первой реакции меньше скорости второй реакции, а энергия активации 1-ой реакции больше, чем Е второй. И при одинаковой температуре Т2 υ2 > υ1. Чем больше энергия активации, тем выше температура, необходимая для достижения данной скорости реакции.
Причина этого в том, что когда Е больше, то существующие межатом-ные связи в молекулах реагирующих компонентов сильнее, и нужно больше энергии на преодоление этих сил. При этом доля активных молекул соответ-ственно меньше.
Из сказанного видно, что величина энергии активации является важ-нейшей характеристикой химического процесса. Она определяет высоту энергетического барьера, преодоление которого представляет собой условие протекание реакции. С другой стороны, она характеризует скорость реакции от температуры, т.е. чем выше энергия активации, тем выше температура для достижения заданной реакции.
Катализ.
Кроме повышения температуры и концентрации веществ, для ускоре-ния химической реакции используют катализаторы, т.е. вещества, которые вводятся в реагирующую смесь, но не расходуются при реакции, а ускоряют ее путем снижения энергии активации.
Процесс увеличения скорости реакции с помощью катализаторов назы-вается катализом.
Катализаторы участвуют в промежуточных реакциях по созданию ак-тивированного комплекса за счет ослабления связей в молекулах исходных веществ, их разложения, адсорбции молекул на поверхности катализатора, либо ввода активных частиц катализатора.
Характер участия катализатора можно пояснить следующей схемой:
Реакция без катализатора: А + В = АВ.
С катализатором Х: А + Х = АХ ® АХ + В = АВ + Х.
Приведем картинку, подобно представленной на рис. 9.
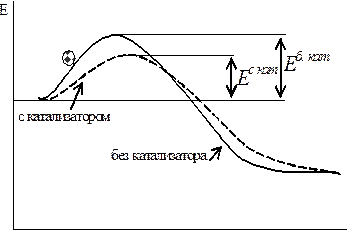
Рис. 11. Схема действия ката-лизатора: Еб.кат и Ес кат – энер-гии активации реакции без ка-тализатора и с катализатором соответственно.
При вводе катализатора (рис. 11) реакция может протекать по иному пути с меньшим энергетическим барьером. Этот путь соответствует новому механизму реакции через образование другого активированного комплекса. И новый более низкий энергетический барьер может преодолеть большее число частиц, что и приводит к увеличению скорости реакции.
Следует отметить, что энергия активации обратной реакции понижает-ся на такую же величину, как и энергия активации прямой реакции, т.е. обе реакции ускоряются одинаково, и катализаторы не инициируют реакцию, они только ускорят реакцию, которая может происходить в их отсутствии, но значительно медленнее.
Катализаторами могут стать промежуточные продукты реакции, тогда эта реакция называется автокаталитической. Так, если скорость обычных ре-акций снижается по мере расходования реагирующих веществ, то реакция горения из-за автокатализа самоускоряется и является автокаталитической.
Наиболее часто в качестве катализаторов используются твердые веще-ства, которые адсорбируют молекулы реагирующих веществ. При адсорбции ослабляются связи в реагирующих молекулах, и таким образом облегчается реакция между ними.
Что же такое адсорбция?
Адсорбция.
Адсорбция – поверхностное поглощение какого-либо вещества из га-зообразной среды или раствора поверхностным слоем другого вещества – жидкости или твердого тела.
Например, адсорбция токсичных газов на поверхности активированно-го угля, используемого в противогазах.
Различают физическую и химическую адсорбцию.
При физической адсорбции захваченные частицы сохраняют свои свойства, а при химической – образуются химические соединения адсорбата с адсорбентом.
Процесс адсорбции сопровождается выделением теплоты. У физической адсорбции она незначительна (1-5 ккал/моль), у химической – значительно больше (10-100 ккал/моль). Тем самым могут ускоряться химические реакции при катализе.
Для процессов горения и взрыва можно привести следующие примеры:
1. Температура самовоспламенения смеси Н2+О2 равна 5000С. В при-сутствии палладиевого катализатора она снижается до 1000С.
2. Процессы самовозгорания угля начинаются с химической адсорбции кислорода на поверхности угольных частиц.
3. При работах с чистым кислородом на одежде хорошо адсорбируется кислород (физическая адсорбция). И при наличии искры или пламени одежда легко вспыхивает.
4. Кислород хорошо адсорбируется и абсорбируется техническими мас-лами с образованием взрывчатой смеси. Смесь взрывается самопроизвольно, без источника зажигания (химическая абсорбция).
Тема 4. ВИДЫ ГОРЕНИЯ.
По разным признакам и особенностям процессы горения можно разде-лить на следующие виды:
По агрегатному состоянию горючего вещества:
- горение газов;
- горение жидкостей и плавящихся твердых веществ;
- горение неплавящихся твердых пылевидных и компактных веществ.
По фазовому составу компонентов:
- гомогенное горение;
- гетерогенное горение;
- горение взрывчатых веществ.
По подготовленности горючей смеси:
- диффузионное горение (пожар);
- кинетическое горение (взрыв).
По динамике фронта пламени:
- стационарное;
- нестационарное.
По характеру движения газов:
- ламинарное;
- турбулентное.
По степени сгорания горючего вещества:
- полное;
- неполное.
По скорости распространения пламени:
- нормальное;
- дефлаграционное;
- детонационное.
Рассмотрим подробнее эти виды.
Дата добавления: 2019-07-26; просмотров: 642;
