Свойства жидкостей.
До сих пор мы рассматривали газы. Но одно и то же вещество в зави-симости от соотношения между средней кинетической и средней потенци-альной энергиями частиц может находиться в одном из трех агрегатных со-стояниях: твердом, жидком или газообразном.
Это соотношение энергий определяется внешними условиями – темпе-ратурой и давлением. Условия перехода газа в жидкость определяются изо-термами состояния вещества. Изотермой называется кривая зависимости объема газа от давления при постоянной температуре.
Рассмотрим пример (рис. 2):
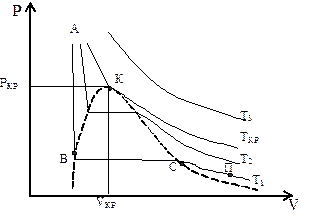
Рис. 2. Изотермы газа при темпера-турах Т1<T2<TКР<T3: АВ – состояние жидкости; В – точка кипения жидко-сти; С – точка сухого насыщенного пара; ВС – кипение жидкости; СП – состояние перегретого пара; К – кри-тическая точка.
Пунктирная кривая ВКС ограничивает область двухфазных состояний вещества (жидкость+пар). Эта кривая и критическая изотерма делят диа-грамму P-V под изотермой на три области. Под кривой ВКС расположена об-ласть двухфазного состояния, в которой жидкость находится в равновесии с насыщенным паром, слева от нее находится область жидкого состояния, а справа область пара. Сверху изотермы АКТКР – газообразное состояние ве-щества. Более четко эти области изображены на рисунке 3.
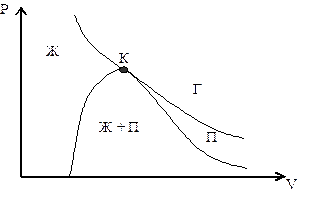
Рис. 3. Фазы состояния в системе жидкость + пар: Ж – жидкость, П – пар, Г – газ.
Пар (П) отличается от газообразного состояния (Г) тем, что при изо-термическом сжатии переходит в жидкое состояние. Газ же при Т>TКР не может быть превращен в жидкость ни при каком давлении. Значения PКР, VКР, TКР называются критическими параметрами газа.
Таким образом, жидкости имеют две фазы: жидкое и парообразное. Ис-парение – это процесс, происходящий с поверхности жидкости. Испарение объясняется вылетом с поверхностного слоя жидкости молекул, обладающих наибольшей скоростью и энергией. Так что в результате испарения жидкость охлаждается.
Следовательно, испарение – это эндотермический процесс высвобож-дения теплоты испарения. Естественно, если испаряется жидкость с какой-то поверхности, то охлаждается и эта поверхность.
Данное свойство жидкости используется, например, при тушении по-жаров водой: резкое испарение воды охлаждает зону горения.
Кстати, наш организм при жаркой погоде выделяет пот. Какой его смысл? А смысл в том, что при испарении пота охлаждается кожа человека, и он не перегревается.
Испарение происходит при любой температуре и возрастает при ее по-вышении до появления кипения. При температуре кипения интенсивное ис-парение происходит не только с ее поверхности, но и во всем объеме жидко-сти с образованием пузырьков пара. При этом эффект охлаждения резко воз-растает.
Если кипение происходит при постоянном давлении, то температура жидкости остается постоянной, т.к. все подводимое тепло тратиться полно-стью на парообразование (рис. 4).
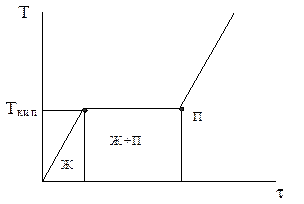
Рис. 4. Термограмма нагрева жид-кости при P = const: Ткип – темпера-тура кипения.
С повышением давления в закрытом сосуде температура кипения воз-растает. Например, ТКИП воды равно 1000С при P=101,3 кПа и ТКИП=1890С при P=1013 кПа (10 атм). Такая ситуация наблюдается, в частности, в паро-вых котлах, где существует вода в жидком виде при температуре выше 1000С (это так называемая перегретая вода), либо в кастрюле-скороварке (при РИЗБ=0,2 атм, ТКИП=1200С).
Если прекратить нагрев и расходовать пар, то кипение продолжается до снижения температуры до 1000С и атмосферного давления. Если же резко сбросить давление (например, при лопнувшей трубе котла), то перегретая во-да мгновенно превращается в пар с резким скачком его давления и взрывом. Напротив, в условиях пониженного давления атмосферы температура кипе-ния снижается. Это повышает взрывоопасность горючих жидкостей, из-за повышения интенсивности испарения и создания взрывоопасных концентра-ций паров.
Каждой температуре жидкости соответствует свое максимально воз-можное количество пара над жидкостью. Это так называемый насыщенный пар, т.е. пар, находящийся в равновесии с жидкостью. Давление такого пара называется упругостью насыщенного пара. Упругость насыщенного пара – это максимально возможное количество пара в воздухе над жидкостью при данной температуре, т.е. максимальное парциальное давление. При более вы-соком содержании пар начинает конденсироваться.
С повышением температуры упругость пара возрастает. Например, для водяных паров при 00С она равна 611 Па, или 0,6 %, при 200С – 2,3%, при температуре кипения 1000С – 100% (рис. 5).
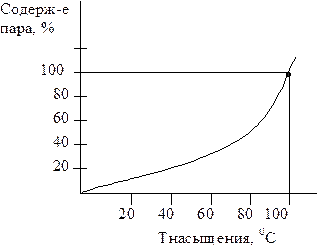
Рис. 5. Диаграмма упругости
насыщенного пара.
Зависимость давления насыщенного пара Рн от температуры жидкости Тж рассчитывается по уравнению Антуана:
lgPH = A – B/(C + Tж), (2.18)
где: А, В, С – термодинамические константы.
Это уравнение используется для оценки условий взрываемости паро-воздушных смесей.
Дата добавления: 2019-07-26; просмотров: 349;
