Свойства газовых смесей.
Свойства газов.
Основное уравнение кинетической теории газов имеет вид:
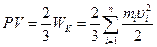 , (2.1)
, (2.1)
где: WK – суммарная кинетическая энергия поступательного движе-
ния n молекул газа, находящегося в объеме V;
mi, ui – масса и скорость движения i-той молекулы.
В результате беспорядочного движения и соударений газа происходит изменение скорости и энергий частиц. Возникают явления направленного пе-реноса внутренней энергии, т.е. теплопроводность, и переноса массы частиц, – диффузия с выравниванием того и другого в объеме вещества.
Теплопроводность возникает в веществе при наличии градиента тем-ператур:
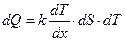 , (2.2)
, (2.2)
где: dQ – количество теплоты переносимой за время dT через поверх-ность dS по направлению нормали Х к этой поверхности в сторо-ну убывания температуры;
(dT/dх) – градиент температуры;
k – коэффициент теплопроводности, равный количеству теплоты, перенесенный через единицу поверхности за единицу времени при градиенте dT/dх=1.
Согласно кинетической теории газов:
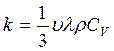 , Дж/(см×сек×град) (2.3)
, Дж/(см×сек×град) (2.3)
где: υ – средняя скорость теплового движения молекул;
l - средняя длина свободного пробега молекул;
r - плотность газа;
CV – удельная теплоемкость газа при постоянном объеме.
Диффузией называется процесс установления внутри фаз какой-то сис-темы равномерного распределения концентрации газа.
Фазой называется совокупность всех гомогенных частей системы. В гомогенной системе нет поверхностей раздела фаз (например, газовая фаза, раствор, твердая фаза), т.е. фаза находится в одном агрегатном состоянии. Система, состоящая из двух и более фаз, называется гетерогенной.
В двухкомпонентной системе явление диффузии описывается законом Фика:
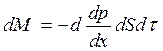 , (2.4)
, (2.4)
где: dM – масса первого компонента, которая переносится за время dt через площадь dS в направлении нормали Х к этой площадке в сторону убывания плотности первого компонента;
dr/dx – градиент плотности;
d – коэффициент диффузии.
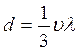 , см2/сек. (2.5)
, см2/сек. (2.5)
Теплоемкостью называется количество тепла, необходимое для повы-шения температуры вещества на один градус:
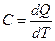 , Дж/(г×К) (2.6)
, Дж/(г×К) (2.6)
Различают CP – теплоемкость при P=const и CV – теплоемкость при V=const, которые объединяются соотношением:
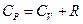 , (2.7)
, (2.7)
где: R – универсальная газовая постоянная, равная работе, совершае-мой 1 молем идеального газа при изобарном нагреве P=const на 1 градус:
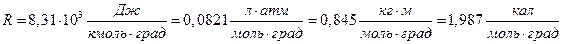 .
.
Понятия «моль», «R» вытекают из основных законов идеальных газов (идеальным газом называется газ, молекулы которого не взаимодействуют друг с другом).
Кроме закона Бойля-Мариотта это следующие законы:
1. Закон Авогадро: Равные объемы газов при одинаковых температуре и давлении содержат одинаковое число молекул.
Различие в массах веществ определяется разными весами их атомов и молекул. За единицу массы в молекулярной теории принят моль (г-молеку-ла). 1 моль – такая масса химически однородного вещества, которая (в грам-мах) численно равна его молекулярному весу.
Иногда закон Авогадро гласит так: «При одинаковых давлениях и тем-пературах грамм-молекулы различных идеальных газов имеют одинаковые объемы».
Число Авогадро: в 1 моле газа содержится 6,02×1023 молекул. Тогда 1 моль любого газа при 0 оС и 101,3 кПа занимает объем 22,414 л.
Другими словами, молекулярный вес – это вес 6,02×1023 молекул газа, выраженный в граммах. Тогда PV=22,4 л×атм/моль при 0 0С.
Например: атомный вес кислорода – 16. Молекулярный вес 16´2=32 г. Тогда в 32 г О2 содержится 6,02×1023 молекул О2.
Можно рассчитать удельный вес (плотность) газа при нормальных фи-зических условиях:
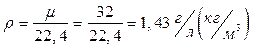 .
.
где: m - молекулярный вес газа.
2. Закон Гей-Люссака: при P=const объем массы газа прямо пропорцио-нален его абсолютной температуре:
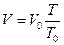 , (2.8)
, (2.8)
где: Т0=273 К;
V0 – объем газа при Т0.
3. Закон Шарля: при V=const давление данной массы газа прямо про-порционально его абсолютной температуре:
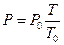 , (2.9)
, (2.9)
где: P0 – давление при Т0=273 К.
4. Уравнение состояния идеального газа для 1 моля газа:
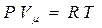 , (2.10)
, (2.10)
где: P, Vμ и T – давление, молекулярный объем и абсолютная темпе-
ратура газа.
5.Уравнение Менделеева-Клайперона для произвольной массы газа (М):
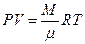 , (2.11)
, (2.11)
Связь ТГВ с рассмотренными законами и свойствами газов можно показать на следующих примерах.
1. Горение представляет собой комплекс взаимосвязанных физических и химических процессов. Важнейшими из них при горении являются тепло- и массоперенос. Наиболее общим свойством горения является способность возникшего очага (фронта) пламени перемещаться по горючей смеси путем теплопроводности и диффузии активных частиц из зоны горения в свежую смесь. Таким образом, скорость распространения пламени при горении и взрыве зависит от теплопроводности реагирующих веществ. С увеличением теплопроводности скорость горения возрастает.
2. Теплоемкость учитывается в термодинамических расчетах горения и выборе огнетушащих средств. Этот параметр относится как к физике, так и к термохимии, т.к. горение – это химическая реакция. Зависимость теплоемко-сти от температуры веществ выражается уравнением:
CP =a+bT+cT2, (2.12)
где: а, b, c – термодинамические константы.
3. R входит во все уравнения ТГВ.
4. Диффузия объясняет возникновение и протекание так называемого диффузионного горения.
5. На базе основных законов идеальных газов выведены постулаты тео-рии горения и самовоспламенения.
6. Законы идеальных газов являются основой расчетов давления, объе-ма, температуры в процессах горения и взрыва.
Правильная организация противопожарных мероприятий и тушения пожаров невозможна без понимания сущности химических и физических процессов, которые происходят при горении. Знание этих процессов дает возможность успешно бороться с огнем.
Горение- это химическая реакция окисления, сопровождающаяся выделением большого количества тепла и обычно свечением. Окислителем в процессе горения может быть кислород, а также хлор, бром и другие вещества.
В большинстве случаев при пожаре окисление горючих веществ происходит кислородом воздуха. Этот вид окислителя и принят в дальнейшем изложении. Горение возможно при наличии вещества, способного гореть, кислорода (воздуха) и источника зажигания. При этом необходимо, чтобы горючее вещество и кислород находились в определенных количественных соотношениях, а источник зажигания имел необходимый запас тепловой энергии.
Известно, что в воздухе содержится около 21% кислорода. Горение большинства веществ становится невозможным, когда содержание кислорода в воздухе понижается до 14-18%, и только некоторые горючие вещества (водород, этилен, ацетилен и др.) могут гореть при содержании кислорода в воздухе до 10% и менее. При дальнейшем уменьшении содержания кислорода горение большинства веществ прекращается.
Горючее вещество и кислород являются реагирующими веществами и составляют горючую систему, а источник зажигания вызывает в ней реакцию горения. Источником зажигания может быть горящее пли накаленное тело, а также электрический разряд, обладающий запасом энергии, достаточным для возникновения горения и др.
Горючие системы подразделяются на однородные и неоднородные. Однородными являются системы, в которых горючее вещество и воздух равномерно перемешаны друг с другом (смеси горючих газов, паров с воздухом). Горение таких систем называют горением кинетическим. Скорость его определяется скоростью химической реакции, значительной при высокой температуре. При определенных условиях такое горение может носить характер взрыва или детонации. Неоднородными являются системы, в которых горючее вещество и воздух не перемешаны друг с другом и имеют поверхности раздела (твердые горючие материалы и нераспыленные жидкости). В процессе горения неоднородных горючих систем кислород воздуха проникает (диффундирует) сквозь продукты горения к горючему веществу и вступает с ним в реакцию. Такое горение называют диффузионным горением,так как его скорость определяется главным образом сравнительно медленно протекающим процессом-диффузией.
Для возгорания тепло источника зажигания должно быть достаточным для превращения горючих веществ в пары и газы и для нагрева их до температуры самовоспламенения. По соотношению горючего и окислителя различают процессы горения бедных и богатых горючих смесей. Бедные смеси содержат в избытке окислитель и имеют недостаток горючего компонента. Богатые смеси, наоборот, имеют в избытке горючий компонент и в недостатке окислитель.
Возникновение горения связано с обязательным самоускорением реакции в системе. Процесс самоускорения реакции окисления с переходом ее в горение называется самовоспламенением. Самоускорение химической реакции при горении подразделяется на три основных вида: тепловой, цепной и комбинированный - цепочечно-тепловой. По тепловой теории процесс самовоспламенения объясняется активизацией процесса окисления с возрастанием скорости химической реакции. По цепной теории процесс самовоспламенения объясняется разветвлением цепей химической реакции. Практически процессы горения осуществляются преимущественно по комбинированному цепочечно-тепловому механизму.
Сгорание различают полное и неполное. При полном сгорании образуются продукты, которые неспособны больше гореть: углекислый газ, сернистый газ, пары воды. Неполное сгорание происходит, когда к зоне горения затруднен доступ кислорода воздуха, в результате чего образуются продукты неполного сгорания: окись углерода, спирты, альдегиды и др.
Ориентировочно количество воздуха (м3), необходимое для сгорания 1 кг вещества (или 1 м3 газа),

где Q - теплота сгорания, кДж/кг, или кДж/м3.
Теплота сгорания некоторых веществ: бензина-47 000 кДж/кг; древесины воздушно-сухой -14 600 кДж/кг; ацетилена - 54400 кДж/м3; метана - 39400 кДж/м3; окиси углерода - 12600 кДж/м3.
По теплоте сгорания горючего вещества можно определить, какое количество тепла выделяется при его сгорании, температуру горения, давление при взрыве в замкнутом объеме и другие данные.
Температура горения вещества определяется как теоретическая, так и действительная. Теоретической называется температура горения, до которой нагреваются продукты сгорания, в предположении, что все тепло, выделяющееся при горении, идет на их нагревание.
Теоретическая температура горения
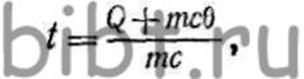
где m - количество продуктов горения, образующихся при сгорании 1 кг вещества; с - теплоемкость продуктов горения, кДж/ (кг*К); θ - температура воздуха, К; Q - теплота сгорания, кДж/кг.
При рассмотрении процессов горения следует различать следующие его виды: вспышка, возгорание, воспламенение, самовоспламенение, самовозгорание, взрыв.
Вспышка- это быстрое сгорание горючей смеси, не сопровождающееся образованием сжатых газов.
Возгорание- возникновение горения под воздействием источника зажигания.
Воспламенение- возгорание, сопровождающееся появлением пламени.
Возгораемость- способность возгораться (воспламеняться) под воздействием источника зажигания.
Самовозгорание- это явление резкого увеличения скорости экзотермических реакций, приводящее к возникновению горения веществ (материала, смеси) при отсутствии источника зажигания.
Самовоспламенение- это самовозгорание, сопровождающееся появлением пламени.
Взрывомназывается чрезвычайно быстрое химическое (взрывчатое) превращение вещества, сопровождающееся выделением энергии и образованием сжатых газов, способных производить механическую работу.
Необходимо понимать различие между процессами возгорания (воспламенения) и самовозгорания (самовоспламенения). Для того чтобы возникло воспламенение, необходимо внести в горючую систему тепловой импульс, имеющий температуру, превышающую температуру самовоспламенения вещества. Возникновение же горения при температурах ниже температуры самовоспламенения относят к процессу самовозгорания (самовоспламенения).
Горение при этом возникает без внесения источника зажигания - за счет теплового или микробиологического самовозгорания.
Тепловое самовозгораниевещества возникает в результате самонагревания под воздействием скрытого или внешнего источника нагрева. Самовоспламенение возможно только в том случае, если количество тепла, выделяемого в процессе самоокисления, будет превышать отдачу тепла в окружающую среду.
Микробиологическое самовозгорание возникает в результате самонагревания под воздействием жизнедеятельности микроорганизмов в массе вещества (материала, смеси). Температура самовоспламенения является важной характеристикой горючего вещества.
Температура самовоспламенения - это самая низкая температура вещества, при которой происходит резкое увеличение скорости экзотермических реакций, заканчивающееся возникновением пламенного горения.
Температуры самовоспламенения некоторых жидкостей, газов и твердых веществ, имеющих применение в машиностроительной промышленности, приведены в табл. 28.
Таблица 28 Температуры самовоспламенения некоторых жидкостей
| Вещество | Температура самовоспламенения, °С |
| Фосфор белый | 20 |
| Сероуглерод | 112 |
| Целлулоид | 140-180 |
| Сероводород | 246 |
| Масла нефтяные | 250-400 |
| Керосин | 250 |
| Бензин А-76 | 255 |
| Мазуты | 380-420 |
| Каменный уголь | 400 |
| Ацетилен | 406 |
| Этиловый спирт | 421 |
| Древесный уголь | 450 |
| Нитробензол | 482 |
| Водород | 530 |
| Ацетон | 612 |
| Бензол | 625 |
| Окись углерода | 644 |
| Кокс | 700 |
Помимо температуры самовоспламенения, горючие вещества характеризуются периодом индукции или временем запаздывания самовоспламенения. Периодом индукции называют промежуток времени,
в течение которого происходит саморазогревание до воспламенения. Период индукции для одного и того же горючего вещества неодинаков и находится в зависимости от состава смеси, начальных температуры и давления.
Период индукции имеет практическое значение при действии на горючее вещество маломощных источников воспламенения (искры). Искра, попадая в горючую смесь паров или газов с воздухом, нагревает некоторый объем смеси, и в то же время происходит охлаждение искры. Воспламенение смеси зависит от соотношения периода индукции смеси и времени охлаждения искры. При этом, если период индукции больше времени охлаждения искры, то воспламенения смеси не произойдет.
Период индукции принят в основу классификации газовых смесей по степени их опасности в отношении воспламенения. Период индукции пылевых смесей зависит от размера пылинок, количества летучих веществ, влажности и других факторов.
Некоторые вещества могут самовозгораться, находясь при обычной температуре. Это в основном твердые пористые вещества большей частью органического происхождения (опилки, торф, ископаемый уголь и др.). Склонны к самовозгоранию и масла, распределенные тонким слоем по большой поверхности. Этим обусловлена возможность самовозгорания промасленной ветоши. Причиной самовозгорания промасленных волокнистых материалов является распределение жировых веществ тонким слоем на их поверхности и поглощение кислорода из воздуха. Окисление масла кислородом воздуха сопровождается выделением тепла. В случае, когда количество образующегося тепла превышает теплопотери в окружающую среду, возможно возникновение пожара.
Пожарная опасность веществ, склонных к самовозгоранию, очень велика, поскольку они могут загораться без всякого подвода тепла при температуре окружающей среды ниже температуры самовоспламенения веществ, а период индукции самовозгорающихся веществ может составлять несколько часов, дней и даже месяцев. Начавшийся процесс ускорения окисления (разогревания вещества) можно остановить лишь при обнаружении опасного нарастания температуры, что указывает на большое значение пожарно-профилактических мероприятий.
На машиностроительных предприятиях применяются многие вещества, способные к самовозгоранию. Самовозгораться при взаимодействии с воздухом могут сульфиды железа, сажа, алюминиевая и цинковая пудра и др. Самовозгораться при взаимодействии с водой могут щелочные металлы, карбиды металлов и др. Карбид кальция (СаС2), реагируя с водой, образует ацетилен (С2Н2).
Свойства газовых смесей.
При рассмотрении смесей газов добавляются понятия: «концентрация» и «парциальное давление».
1. Весовая концентрация Сi i–го газа, входящего в состав смеси, – это отношение его массы Mi к массе всей смеси:
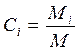 , (2.13)
, (2.13)
где: 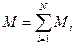 , N – количество газов.
, N – количество газов.
2. Молярная концентрация (хi) i–го газа называется отношение числа молей этого газа к числу молей всех газов в смеси:
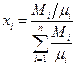 , (2.14)
, (2.14)
Например, рассмотрим реакцию стехиометрической смеси водорода и кислорода: 2H2+O2=2H2O.
Здесь участвуют 2 моля Н2 и 1 моль О2. Всего 2 + 1 = 3 моля смеси.
Тогда: 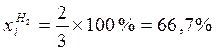 ;
; 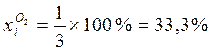 .
.
Дата добавления: 2019-07-26; просмотров: 521;
