Применение электролиза
Электролиз – окислительно-восстановительные реакции, протекающие под действием постоянного электрического тока на поверхности электродов, помещенных в расплав или раствор электролита.
На отрицательно заряженном электроде – катоде – происходит процесс восстановления ионов или молекул электролита, а на положительно заряженном – аноде – процесс окисления. Последовательность протекания электродных реакций при электролизе зависит от многих факторов, основными из которых являются состав электролита, материал электродов, плотность тока, температура и др. Эти факторы влияют на величины потенциалов электродных систем, образующихся при электролизе, которые и будут определять возможность преимущественного протекания той или иной реакции. Для определения наиболее вероятных катодных и анодных реакций необходимо знать значения равновесных потенциалов и вид поляризационных кривых (см. 8.4) всех возможных электродных систем, которые могут возникнуть при электролизе.
Катодный процесс.Независимо от материала катода на нем будет протекать реакция восстановления только ионов металла ( 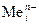 ) при электролизе расплавов и ионов металла или ионов водорода (молекул воды) при электролизе водных растворов электролитов.
) при электролизе расплавов и ионов металла или ионов водорода (молекул воды) при электролизе водных растворов электролитов.
Возможные катодные реакции при электролизе расплава электролита: восстановление катионов металла 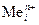 + nē ®
+ nē ® 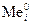 .
.
Возможные катодные реакции при электролизе водного раствора: восстановление катионов металла 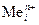 + nē ®
+ nē ® 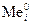 ,
,
восстановление ионов водорода 2H2O + 2ē ®H2 + 2OH- (pH ³7);
2H+ + 2ē ®H2 (pH <7).
Последовательность протекания катодных реакций определяется величиной электродных потенциалов систем, которые возникают при протекании в системе тока. В первую очередь будут восстанавливаться более сильные окислители (Oxi), т. е. ионы или молекулы с большим значением электродного потенциала ( 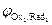 >
> 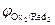 >
> 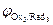 >…>
>…> 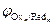 ).
).
 Катодные процессы, протекающие при электролизе водного раствора электролита, условно можно разделить на три группы (рис.8.13).
Катодные процессы, протекающие при электролизе водного раствора электролита, условно можно разделить на три группы (рис.8.13).
Рис. 8‑13 Схема поляризационных кривых восстановления ионов металлаи молекул воды на катоде при рН =const
1. Восстановление только ионов металла: Men+ + nē ® Me0.
Данная реакция протекает при электролизе растворов, содержащих катионы, стандартные потенциалы которых больше потенциала стандартного водородного электрода, т. е. 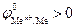 . Этому случаю на рис.8.13 соответствует ион металла
. Этому случаю на рис.8.13 соответствует ион металла 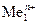 . В системе, независимо от величины плотности тока и pH раствора,
. В системе, независимо от величины плотности тока и pH раствора, 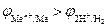 . При токе i потенциал катода равен j1, а скорость выделения металла
. При токе i потенциал катода равен j1, а скорость выделения металла 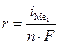 определяется величиной
определяется величиной 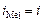 .
.
Если в растворе имеется несколько катионов, стандартные потенциалы которых положительны: 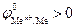 , то среди них в первую очередь восстанавливаются те, у которых величина электродного потенциала больше.
, то среди них в первую очередь восстанавливаются те, у которых величина электродного потенциала больше.
При электролизе расплавов в системе не образуется водородный электрод и на катоде восстанавливаются металлы с любым значением стандартного электродного потенциала.
2. Восстановление только молекул воды или ионов водорода. При pH ³7 реакция записывается как 2H2O + 2ē ®H2 + 2OH-, а при pH<7 – 2H+ + 2ē ®H2.
Данная реакция протекает при электролизе растворов, содержащих катионы, стандартные потенциалы которых существенно меньше потенциала стандартного водородного электрода: 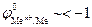 В. В этом случае, независимо от величины плотности тока и pH раствора,
В. В этом случае, независимо от величины плотности тока и pH раствора, 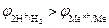 . Этому случаю на рис.8.13 соответствует ион металла
. Этому случаю на рис.8.13 соответствует ион металла 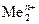 . При токе i потенциал катода равен j2, а скорость выделения водорода
. При токе i потенциал катода равен j2, а скорость выделения водорода 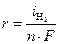 определяется величиной
определяется величиной 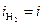 .
.
3. Если 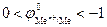 В, то, в зависимости от условий, в основном от плотности тока и от концентрации ионов водорода (pH электролита), возможно восстановление как ионов металла, так и молекул воды или ионов водорода.
В, то, в зависимости от условий, в основном от плотности тока и от концентрации ионов водорода (pH электролита), возможно восстановление как ионов металла, так и молекул воды или ионов водорода.
Вероятность протекания этих реакций определяется величиной неравновесных электродных потенциалов водородного и металлического электродов. Этому случаю на рис.8.13 соответствует ион металла 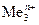 . При малых плотностях тока (i<ip)
. При малых плотностях тока (i<ip) 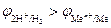 и происходит восстановление преимущественно водорода. При больших плотностях тока(i>ip) одновременно протекают обе реакции, причем скорость восстановления металла (
и происходит восстановление преимущественно водорода. При больших плотностях тока(i>ip) одновременно протекают обе реакции, причем скорость восстановления металла ( 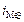 ) больше, чем скорость восстановления водорода (
) больше, чем скорость восстановления водорода ( 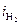 ). В точке р скорости восстановления металла и водорода равны. При больших величинах плотности тока
). В точке р скорости восстановления металла и водорода равны. При больших величинах плотности тока 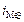 >>
>> 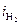 , т. е. на катоде будет происходить преимущественно восстановление ионов металла.
, т. е. на катоде будет происходить преимущественно восстановление ионов металла.
Примечание.На катоде может происходить восстановление и других ионов или молекул окислителей, содержащихся в раствореOx + nē ® Red, например,
O2 + 2H2О + 4ē ® 4ОH-.
Анодный процесс. В отличие от катода, на котором происходил процесс восстановления компонентов электролита, анодной реакцией может быть реакция окисления как ионов и молекул электролита, так и вещества самого анодаRedi ® Oxi+ nē. Последовательность протекания анодных реакций определяется величиной электродных потенциалов, которые возникают при протекании в системе тока. В первую очередь будут окисляться частицы-восстановители (Redi) с меньшим значением электродного потенциала ( 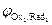 <
< 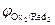 <
< 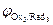 <…<
<…< 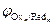 ).
).
Анодные процессы, протекающие при электролизе водного раствора электролита, условно можно разделить на три группы (рис.8.14).
1. Электролиз с растворимым анодом (активный анод). Если материалом анода служит металл, потенциал которого меньше потенциала кислородного электрода 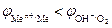 или других частиц, присутствующих в электролите, то происходит окисление металла: Me0 ® Men+ + nē. На рис.8.14 этому случаю соответствует поляризационная кривая 1. При токе i потенциал анода равен j1, а скорость растворения металла
или других частиц, присутствующих в электролите, то происходит окисление металла: Me0 ® Men+ + nē. На рис.8.14 этому случаю соответствует поляризационная кривая 1. При токе i потенциал анода равен j1, а скорость растворения металла 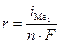 определяется величиной
определяется величиной 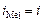 .
.
2. Электролиз с нерастворимым анодом (инертный анод). Если потенциал металла или любого другого проводника первого рода, используемого в качестве анода, больше потенциала кислородного электрода 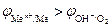 или других частиц, содержащихся в электролите, то материал анода не участвует в реакции окисления. В качестве инертных анодов используются графит, золото, металлы платиновой группы и другие материалы.
или других частиц, содержащихся в электролите, то материал анода не участвует в реакции окисления. В качестве инертных анодов используются графит, золото, металлы платиновой группы и другие материалы.

Рис. 8‑14 Схема поляризационных кривых окисления металла, молекул воды и анионов на аноде при рН =const
Если в водном растворе электролита присутствуют кислородосодержащие анионы, например SO42-, NO3-, PO43- и др., электродный потенциал которых больше потенциала кислородного электрода, то на аноде происходит только реакция окисления молекул воды (pH£7) или ионов ОH- (pH>7):
2H2O ® О2 + 4H+ + 4ē при pH£7,
4ОH- ® О2 + 2H2O + 4ē при pH>7.
На рис.8.14 этому случаю соответствует поляризационная кривая 2. При токе i потенциал анода равен j2, а скорость выделения кислорода 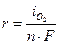 определяется величиной
определяется величиной 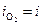 .
.
3. Электролиз с инертным анодом электролитов, содержащих анионы галогенводородных кислот (Cl-, Br-, I-). Вследствие высокой поляризации реакции выделения кислорода на аноде в первую очередь окисляются ионы галогена, образуется иод (I2), бром (Br2). В случае с хлорид-ионом при малых плотностях тока идет выделение кислорода, а при больших плотностях преимущественно окисляются ионы Cl- с образованием хлора:
2Cl- ® 2ē + Cl2
На рис.8.14 этому случаю соответствует поляризационная кривая 3. При потенциале анода j3 скорость выделения хлора определяется величиной 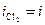 , а кислорода
, а кислорода 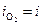 .
.
Примечание.Фтор, вследствие большой величины электродного потенциала, при электролизе водных растворов не образуется, его получают при электролизе расплавов фторидов металлов.
Пример 1. Электролиз водного раствора сульфата натрия (Na2SO4) концентрация 1 моль/л (pH =7) с инертным анодом (графит).
В растворе в результате диссоциации Na2SO4 ↔ 2Na+ + SO42- образуются ионы Na+ и SO42-. При рН =7 равновесный потенциал водородного электрода равен 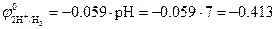 В, а
В, а 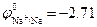 В. Поскольку
В. Поскольку 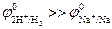 , то на катоде происходит восстановление молекул воды с образованием водорода. Так как SO42- –кислородосодержащий анион, то на аноде происходит окисление молекул воды с образованием кислорода:
, то на катоде происходит восстановление молекул воды с образованием водорода. Так как SO42- –кислородосодержащий анион, то на аноде происходит окисление молекул воды с образованием кислорода:
катод (+) (С) 2H2O + 2ē ®H2 + 2OH-
анод (-)(С) 2H2O ® О2 + 4H+ + 4ē
Суммарное уравнение протекающей в системе реакции:
4H2O+ 4ē +2H2O ® 2H2+4OH- + О2 + 4H+ + 4ē
2H2O® 2H2 + О2
При электролизе происходит разложение воды, растворенное вещество в этом случае не участвует в электрохимических реакциях. Его роль сводится к переносу зарядов в электролите (ток внутренней цепи).
Пример 2. Электролиз водного раствора нитрата серебра AgNO3 с инертным анодом (графит).
В растворе в результате диссоциации AgNO3 ↔ Ag+ + NO3- образуются ионы Ag+ и NO3-.
Поскольку стандартный электродный потенциал 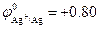 В положительный, то на катоде происходит восстановление ионов серебра. Так как NO3- – кислородосодержащий анион, то на аноде происходит окисление молекул воды с образованием кислорода:
В положительный, то на катоде происходит восстановление ионов серебра. Так как NO3- – кислородосодержащий анион, то на аноде происходит окисление молекул воды с образованием кислорода:
катод (+)(С) Ag+ + ē ®Ag
анод (-)(С) H2O ® О2 + 4H+ + 4ē
Суммарное уравнение реакции, протекающей в системе:
4Ag+ + 2H2O+ 4ē ® 4 Ag +О2 + 4H+ + 4ē
4AgNO3+ 2H2O® 4 Ag + О2+4H NO3
Пример 3. Электролиз водного раствора сульфата меди CuSO4 с медными электродами.
В растворе в результате диссоциации CuSO4 ↔ Cu2+ + SO42- образуются ионы Cu2+ и SO42-.
Стандартный электродный потенциал 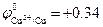 В положительный, поэтому на катоде происходит восстановление ионов меди. Так как медный электрод является активным (растворимым) анодом, то при электролизе происходит окисление меди:
В положительный, поэтому на катоде происходит восстановление ионов меди. Так как медный электрод является активным (растворимым) анодом, то при электролизе происходит окисление меди:
катод (+) (Сu) Cu2+ + 2ē ® Cu
анод (-)(Сu) Cu ® Cu2+ + 2ē
Из суммарного уравнения протекающей в системе реакции:
Cu2+ + 2ē + Cu ® Cu + Cu2+ + 2ē
видно, что в этом случае образование новых веществ не происходит. При электролизе осуществляется перенос атомов меди с анода на катод.
Электролиз является основой различных технологических процессов, в частности:
- при электролизе расплавленных соединений получают алюминий, магний, щелочные и щелочноземельные и другие химически активные металлы (электрометаллургия);
- при электролизе водных растворов получают металлы, не загрязненные примесями: медь, никель, цинк, марганец (гидрометаллургия);
- электролиз водных растворов используют для получения на поверхности изделий металлических покрытий (гальваностегия) или точных металлических копий (гальванопластика);
- электролиз с растворимым анодом лежит в основе процессов рафинирования (очистки) металлов: меди, никеля, серебра;
- процессы анодного растворения используются для электрохимической обработки металлов: электрополирования, электро-фрезерования и др.
- электролизом получают различные химические вещества: хлор, водород и кислород, гидроксид натрия и др.
Контрольные вопросы.
1. Электрохимический процесс. Количественные соотношения между величиной тока и количеством реагентов.
2. Двойной электрический слой на границе «металл – электролит». Электродный потенциал. Уравнение Нернста.
3. Химический и концентрационный гальванические элементы: ЭДС, электродные реакции.
4. Скорость электрохимической реакции. Поляризация электродов.
5. Химические источники тока.
6. Электролиз расплавов и водных растворов электролитов.
Дата добавления: 2017-02-20; просмотров: 1676;
