Скорость электрохимических процессов
Скорость электрохимической реакции, т. е. скорость электродного процесса(r), определяется числом молей вещества (n), образовавшегося или израсходовавшегося на единице площади поверхности электрода (S) в единицу времени: 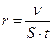 . Поскольку количество веществ, претерпевших превращение на электродах, величина тока (I) и время протекания процесса (t) связаны соотношением
. Поскольку количество веществ, претерпевших превращение на электродах, величина тока (I) и время протекания процесса (t) связаны соотношением 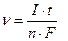 [моль] (см. 8.1), то скорость электродного процесса можно рассчитать по плотности тока (i):
[моль] (см. 8.1), то скорость электродного процесса можно рассчитать по плотности тока (i):
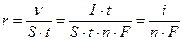 ,
,
где 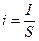 , [A/м2] – плотность тока; S, м2 – площадь поверхности электрода; n – число электронов, участвующих в единичном акте электродной реакции; F – число Фарадея.
, [A/м2] – плотность тока; S, м2 – площадь поверхности электрода; n – число электронов, участвующих в единичном акте электродной реакции; F – число Фарадея.
Из уравнения видно, что плотность тока, по сути, является характеристикой скорости электрохимической реакции на электроде.
Очевидно, что величины токов, протекающих через катод и анод, равны: Iк º Iа º I. Если площади катода и анода равны: Sк=Sа, то равны и плотности катодного и анодного токов: iк = iа. При Sк ¹ Sа iк¹iа.
Если в электрохимической системе протекает ток, то равновесие Ox + nē ↔ Red нарушается и система переходит в неравновесное состояние. На электродах протекают реакции преимущественно в одном направлении: на аноде – окисление: Redа®Oxа+ nē, а на катоде – восстановление: Oxк + nē®Redк. Это приводит к изменению величин электродных потенциалов и, соответственно, величины разности потенциалов.
Разность между потенциалом электрода при прохождении в электрохимической системе тока (jI) и равновесным потенциалом (j) при I=0 называется электродной поляризацией: h = jI - j.
Величина электродной поляризации в основном зависит от величины плотности тока. Эту зависимость показывают поляризационные кривые – зависимости jI = f(i) или i = f(jI). Для анодного процесса h>0, т. е. потенциал анода при прохождении тока увеличивается. Для катодного процесса h<0, т. е. потенциал катода при прохождении тока уменьшается. Соответственно при работе гальванического элемента величина разности потенциалов электродов (U) становится меньше, чем ЭДС электрохимической системы (U < E), а при электролизе - больше (U> E).
Явление поляризации электродов вытекает из термодинамики. Максимальную величину работы системы можно получить только в равновесном процессе (для электрохимической системы это отсутствие тока в цепи). В неравновесных условиях в самопроизвольном процессе (работа гальванического элемента) совершаемая системой работа меньше, чем равновесная (U < E). В вынужденном процессе (электролиз) работа окружающей среды больше, чем равновесная (U > E). Степень отклонения системы от состояния равновесия определяется величиной тока в цепи: при I=0 h=0, с увеличением плотности тока i возрастает абсолютная величина h.
Пример. Поляризация электродов в электрохимической системе, состоящей из цинкового и медного электрода первого рода Zn|Zn2+||Cu2+|Cu, находящейся в стандартных условиях (рис.8.11).

Рис. 8‑11 Схема поляризации в электрохимической системе, состоящей из цинкового и медного электрода первого рода Zn|Zn2+||Cu2+|Cu
В состоянии равновесия I=0 (цепь разомкнута, сопротивление внешней цепи бесконечно большое: Rв=∞). Равновесные потенциалы электродов равны соответствующим стандартным потенциалам: 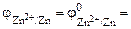 -0,76 В;
-0,76 В; 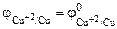 =+0,34 В, а их разность E = (jк – jа)соответствует ЭДС гальванического элемента.
=+0,34 В, а их разность E = (jк – jа)соответствует ЭДС гальванического элемента.
Протекание электрического тока в цепи осуществляется или самопроизвольно в гальваническом элементе, или вынужденно при электролизе.
а) Если сопротивление внешней цепи уменьшить (Rв¹∞), то система будет работать как гальванический элемент (-)Zn|Zn2+||Cu2+|Cu(+). На электродах самопроизвольно протекают реакции:
анод (-) - цинк окисление Zn0® Zn2++2ē
катод (+) - медь восстановление Cu2++2ē ® Cu0
Во внешней цепи будет течь ток: электроны с цинкового электрода перетекают на медный. Напряжение на электродах (U) – измеряемая величина разности потенциалов - будет меньше, чем ЭДС гальванического элемента, на величину поляризации анода и катода: U = (jI)к – (jI)а. Поскольку h = jI - j, то jI = j - h.
Поскольку для анодного процесса h>0, а для катодного процесса h<0, то можно записать:
U = (j - ½hк½)к – (j+ ½hа½)а = (jк – jа) – (½hк½ + ½hа½) = E - hГЭ,
где E – ЭДС гальванического элемента, E = jк – jа; hГЭ – поляризация гальванического элемента, hГЭ = ½hк½ + ½hа½.
Поскольку величина поляризации электродов увеличивается с ростом плотности тока, то напряжение (U) уменьшается и при некотором значении плотности тока (imax) становится равным нулю – система приходит в состояние полной поляризации.
б) Если во внешнюю цепь включить источник тока таким образом, чтобы электроны переходили с медного электрода на цинковый, то в системе (+)Cu|Cu2+||Zn2+|Zn(-) будет происходить электролиз, и она будет электролизером. На электродах протекают вынужденные реакции:
анод (-) - медь окисление Cu0® Cu2++2ē
катод (+) - цинк восстановление Zn2++2ē ® Zn0.
Ток в цепи будет протекать, если напряжение источника тока будет больше, чем потенциал разложения, равный разности потенциалов электродов в состоянии равновесия (ЭДС гальванического элемента). Напряжение, вызывающее электролиз, с ростом плотности тока будет увеличиваться на величину, равную поляризации анода и катода:
U = (jк – jа) + (½hк½ + ½hа½) = E + hЭл,
где E – ЭДС гальванического элемента, E = jк – jа; hЭл – поляризация при электролизе, hЭл = ½hк½ + ½hа½.
Дата добавления: 2017-02-20; просмотров: 3083;
