Окислительно-восстановительные реакции в водных растворах
Окислительно-восстановительные реакции сопровождаются перераспределением электронов между атомами, входящими в состав реагентов. В этих реакциях всегда имеются две сопряженные пары реагентов «окислитель – восстановитель»: Ox1/Red1; Ox2/Red2. В ходе реакции происходит окисление восстановителя и восстановление окислителя:

гдеRed1 – восстановленная, а Ox1 – окисленная форма вещества 1, аRed2, Ox2 – соответственно вещества 2. Этим реакциям соответствуют равновесные редокс-электроды.
Таким образом, каждой окислительно-восстановительной реакции будет соответствовать реальный или гипотетический гальванический элемент, а работа каждого из них обеспечивается протеканием окислительно-восстановительной реакции.
Термодинамическим условием самопроизвольного протекания реакции в прямом направлении является уменьшение энергии Гиббса (DrG<0). Поскольку изменение энергии Гиббса и разность электродных потенциалов редокс-электродов (Dj) связаны соотношением 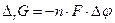 (см. 7.1), где
(см. 7.1), где 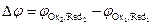 , то направление окислительно-восстановительной реакции в водном растворе можно оценить сравнением величин потенциалов редокс-электродов сопряженных пар. Если сравнить редокс-потенциалы сопряженных пар:
, то направление окислительно-восстановительной реакции в водном растворе можно оценить сравнением величин потенциалов редокс-электродов сопряженных пар. Если сравнить редокс-потенциалы сопряженных пар:
Ox1 + nē ↔ Red1 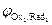 ; Ox2 + nē ↔ Red2
; Ox2 + nē ↔ Red2 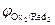 ,
,
то условие DrG<0 для данной реакции будет выполняться, если Dj > 0, т. е. 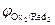 >
> 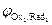 . В этом случае восстановленная форма вещества 1 (Red1) будет являться восстановителем, а окисленная форма вещества 2 (Ox2) – окислителем.
. В этом случае восстановленная форма вещества 1 (Red1) будет являться восстановителем, а окисленная форма вещества 2 (Ox2) – окислителем.
Концентрации реагентов в ходе реакции будут самопроизвольно изменяться в направлении уменьшения энергии Гиббса DrG<0. Равновесие в системе наступит при DrG=0, и соответственно Dj=0( 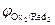 =
= 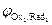 ). С учетом уравнения Нернста для редокс-потенциалов условие равновесия можно записать так:
). С учетом уравнения Нернста для редокс-потенциалов условие равновесия можно записать так:
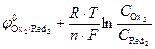 =
= 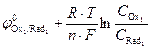 ;
;
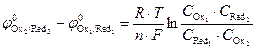 ;
; 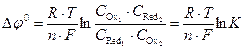 ,
,
где Ci – равновесные концентрации веществ в окисленной и восстановленной форме; К – константа равновесия.
Примечание.Сравнение стандартных электродных потенциалов 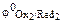 и
и 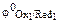 позволяет определить направление самопроизвольного протекания окислительно-восстановительной реакции. В состоянии равновесия концентрация исходных веществ и продуктов реакции будет зависеть от величины разности потенциалов:
позволяет определить направление самопроизвольного протекания окислительно-восстановительной реакции. В состоянии равновесия концентрация исходных веществ и продуктов реакции будет зависеть от величины разности потенциалов: 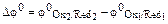 .
.
Если 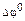 > ~+0,5 В, то можно считать, что реакция идет до конца в прямом направлении, то есть концентрация исходных веществ в системе в состоянии равновесия пренебрежимо мала. Если
> ~+0,5 В, то можно считать, что реакция идет до конца в прямом направлении, то есть концентрация исходных веществ в системе в состоянии равновесия пренебрежимо мала. Если 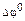 < ~ -0,5 В, то реакция идет до конца в обратном направлении. Если - 0,5 В <
< ~ -0,5 В, то реакция идет до конца в обратном направлении. Если - 0,5 В < 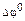 < +0,5 В, то в состоянии равновесия в системе будут находиться как продукты реакции, так и исходные вещества.
< +0,5 В, то в состоянии равновесия в системе будут находиться как продукты реакции, так и исходные вещества.
Необходимо отметить, что величины равновесных концентраций реагентов в значительной степени могут зависеть от pH раствора, если в потенциалопределяющих реакциях принимают участие ионы H+ и OH-.
Изложенные положения можно проиллюстрировать на примере взаимодействия в водном растворе конкретных окислительно-восстановительных пар.
Пример 1. Можно ли окислить в стандартных условиях в кислой среде (pH<7) катион Sn2+ до Sn4+ дихромат-ионом Cr2O72-, или, соответственно, будет ли окисляться катион Cr3+ катионом Sn4+ до аниона Cr2O72-?
По сути, данный вопрос сводится к определению направления реакции
3Sn2+ + Cr2O72- + 14H+ ↔ 3Sn4+ + 2Cr3+ + 7H2O
в которой можно выделить две сопряженные пары реагентов окислитель-восстановитель: Sn4+/Sn2+ и Cr2O72-/Cr3+. Запишем потенциалопределяющие реакции редокс-электродов в порядке увеличения величин их потенциалов:
 Sn4+ + 2ē ↔ Sn2+;
Sn4+ + 2ē ↔ Sn2+; 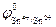 = +0,15 В
= +0,15 В
Cr2O72- + 14H+ + 6ē ↔ 2Cr3+ + 7H2O; 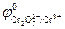 = +1,33 В
= +1,33 В
Равновесие самопроизвольно смещается в сторону окисления на электроде с меньшим значением потенциала и в сторону восстановления – с большим. Поскольку 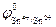 меньше, чем
меньше, чем 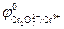 , то самопроизвольно реакция в нижней строке будет протекать в прямом направлении, а в верхней строке – в обратном. Проведенная между реакциями двусторонняя стрелка в форме буквы Z указывает направление самопроизвольно протекающего процесса. Для приведенного примера полуреакции восстановления и окисления и суммарное уравнение записываются в виде
, то самопроизвольно реакция в нижней строке будет протекать в прямом направлении, а в верхней строке – в обратном. Проведенная между реакциями двусторонняя стрелка в форме буквы Z указывает направление самопроизвольно протекающего процесса. Для приведенного примера полуреакции восстановления и окисления и суммарное уравнение записываются в виде

3Sn2+ + Cr2O72- + 14H+ + 6ē ® 3Sn4+ + 3´2ē + 2Cr3+ + 7H2O
Таким образом, дихромат-ион Cr2O72- в кислой среде будет окислять катион Sn2+ до Sn4+. Например, хлорид олова (+2) в среде соляной кислоты будет окисляться дихроматом калия по реакции
3SnCl2 + K2Cr2O7 + 14HCl ® 3SnCl4 + 2CrCl3 + 7H2O + 2KCl
Окисление катиона Cr3+ катионом Sn4+ в стандартных условиях в кислой среде до аниона Cr2O72- невозможно.
Пример 2. Подобрать реагент для окисления катиона Cr3+ в стандартных условиях в кислой среде до аниона Cr2O72-.
Потенциалопределяющая реакция сопряженной пары Cr2O72-/Cr3+ имеет вид Cr2O72- + 14H+ + 6ē ↔ 2Cr3+ + 7H2O; 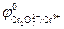 = +1,33 В
= +1,33 В
Для того чтобы окислить ион Cr3+, необходимо подобрать редокс-электрод с большим значением электродного потенциала. Например:
PbO2 + 4H+ + SO42- + 2ē ↔ PbSO4 + 2H2O; 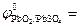 +1,69 В.
+1,69 В.
Сравнение редокспотенциалов сопряженных пар дает следующее направление смещения равновесия в полуреакциях:
 Cr2O72- + 14H+ + 6ē ↔ 2Cr3+ + 7H2O;
Cr2O72- + 14H+ + 6ē ↔ 2Cr3+ + 7H2O; 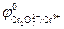 = +1,33 В
= +1,33 В
PbO2 + 4H+ + SO42- + 2ē ↔ PbSO4 + 2H2O; 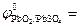 +1,69 В.
+1,69 В.
Для приведенного примера полуреакции восстановления и окисления и суммарное уравнение записываются в вид

2Cr3++7H2O+3PbO2+12H++3SO42- +2´3ē®Cr2O72-+ +14H++6ē+3PbSO4+ 6H2O
2Cr3+ + H2O + 3PbO2 + 3SO42- ® H2Cr2O7 + 3PbSO4
Например, сульфат хрома (+3) в среде серной кислоты в стандартных условиях окисляется диоксидом свинца по реакции:

Электрохимическая устойчивость воды. Вода во многих случаях не только является растворителем, но и участвует в окислительно-восстановительных процессах. Молекулы воды (H2O), а также ионы водорода (H+) и гидроксид-ионы (OH-) могут являться окислителем или восстановителем.
Как окислитель вода восстанавливается до газообразного водорода (H2). Этому процессу соответствуют реакции, протекающие на водородном электроде:
2H+ + 2ē ↔H2 при pH <7;
2H2O + 2ē ↔H2 + 2OH- при pH ³7.
Согласно уравнению Нернста, потенциал водородного электрода линейно уменьшается с увеличением pH электролита. При Т0=298 К и 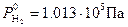 ,
, 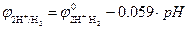 (рис. 8.9). Величина потенциала изменяется от j = 0 В в кислой среде (pH=0) до j = -0,83 В в щелочной (pH=14).
(рис. 8.9). Величина потенциала изменяется от j = 0 В в кислой среде (pH=0) до j = -0,83 В в щелочной (pH=14).
Как восстановитель вода окисляется до газообразного кислорода (O2). Этому процессу соответствуют реакции, протекающие на кислородном электроде:
О2 + 4H+ + 4ē ↔ 2H2O при pH <7;
О2 + 2H2O + 4ē ↔ 4OH- при pH ³7.
Согласно уравнению Нернста потенциал кислородного электрода линейно уменьшается с увеличением pH электролита. При Т0 =298 К и 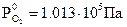 ,
, 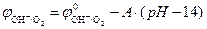 (рис. 8.9). Величина потенциала изменяется от j = +1,23 В в кислой среде (pH=0) до j =+0,40 В в щелочной среде (pH=14).
(рис. 8.9). Величина потенциала изменяется от j = +1,23 В в кислой среде (pH=0) до j =+0,40 В в щелочной среде (pH=14).
Все окислительно-восстановительные пары (Ox/Red), имеющие потенциал ниже потенциала водородного электрода (область I на рис.8.9) в водных растворах, термодинамически неустойчивы. Их восстановленная форма будет окисляться ионами H+ в кислой среде или молекулами H2O в нейтральной и щелочной с выделением газообразного водорода:
Red +2H+ ® Ox + H2, при pH <7;
 Red +2H2O ® Ox +H2 + 2OH-, при pH ³7.
Red +2H2O ® Ox +H2 + 2OH-, при pH ³7.
Рис. 8‑9 Зависимость потенциалов водородного и кислородного электродов от pH электролита при Т0 =298 К и 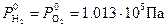
Пример 1. Ионы Cr2+ 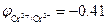 В в кислой среде рН = 3 окисляются ионами водорода
В в кислой среде рН = 3 окисляются ионами водорода 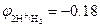 В:
В:
2Cr2+ + 2H+ ® 2Cr3+ + H2, 2CrSO4 + H2SO4 ® Cr2(SO4)3 + +H2.
Пример 2. Окисление металлического натрия 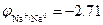 В водой в щелочных растворах рН=13
В водой в щелочных растворах рН=13 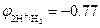 В:
В:
2Na + 2H2O ® 2Na+ +H2 + 2OH-, 2Na + 2H2O ® 2NaOH +H2
Примечание. Кислоты, являющиеся окислителями за счет иона H+ (например, соляная и разбавленная серная кислоты), могут растворить (окислить) металлы, имеющие только отрицательные электродные потенциалы (в электрохимическом ряду напряжений металлов они стоят до водорода).
Все окислительно-восстановительные пары (Ox/Red), имеющие потенциал выше потенциала кислородного электрода (область III на рис.8.9) в водных растворах, термодинамически неустойчивы. Их окисленная форма вступает во взаимодействие с молекулами H2O в кислой среде или с ионами OH- – в нейтральной и щелочной с выделением газообразного кислорода:
Ox + 2H2O ® Red + О2 + 4H+ при pH <7;
Ox + 4OH- ® Red + О2 + 2H2O при pH ³7.
Пример. Восстановление ионов Co3+ 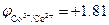 В в кислой среде рН = 2 молекулами воды
В в кислой среде рН = 2 молекулами воды 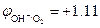 В:
В:
Co3+ + 2H2O ® Co2+ + О2 + 4H+
2Co2(SO4)3 + 2H2O ® 4CoSO4 + О2 + 2H2SO4
Область II на рис.8.9, ограниченная зависимостями потенциалов водородного и кислородного электродов от рН среды, является областью электрохимической устойчивости воды. Если в водном растворе имеются Ox/Red пары, электродные потенциалы которых лежат в области II, то окислительно-восстановительные реакции воды термодинамически невозможны.
Необходимо отметить, что в водных растворах может присутствовать растворенный кислород (О2). В этом случае даже если потенциал Ox/Red пары соответствует области II, то восстановленная форма будет окисляться кислородом по реакциям:
Red + О2 + 4H+ ® Ox + 2H2O, если pH <7;
Red + О2 + 2H2O ® Ox + 4OH- если pH ³7.
Например, медь, имея стандартный потенциал 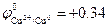 В, не окисляется ионами H+, но растворяется в соляной кислоте в присутствии кислорода:
В, не окисляется ионами H+, но растворяется в соляной кислоте в присутствии кислорода:
Cu0 + О2 + 4H+ ® Cu2+ + 2H2O; Cu + О2 + 4HCl ® CuCl2 + 2H2O
При СHCl = 0,1 моль/л (рН = 1) 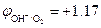 В,
В,
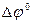 =
= 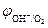 -
- 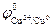 = 1,17 – 0,34 = 0,83 В > 0.
= 1,17 – 0,34 = 0,83 В > 0.
Электролиз
Если в электрохимической системе во внешнюю цепь включен источник электрической энергии, то при протекании постоянного тока на поверхности электродов осуществляются вынужденные реакции. Такой вынужденный окислительно-восстановительный процесс является электролизом. Изменение энергии Гиббса этого процесса DG>0. При электролизе электрическая энергия превращается в энергию химических связей в новых веществах.
Пусть электрохимическую систему образуют электроды первого рода: Me1|(Men+)1||(Men+)2|Me2. Если ток в цепи равен нулю, то на каждом электроде в результате протекания реакций устанавливается равновесный электродный потенциал (ji):
первый электрод: Me1 ↔ (Men+)1 + nē потенциал j1;
второй электрод: Me2 ↔ (Men+)2 + nē потенциал j2.
Если ток в цепи не равен нулю, то система выходит из состояния равновесия. При этом электродные реакции протекают преимущественно в одну сторону: на аноде окисления, а на катоде восстановления. Какой электрод будет анодом, а какой катодом, в данном случае первый или второй, будет зависеть от направления тока в цепи.
Пусть j2 > j1. При замыкании внешней цепи самопроизвольно (DG<0) будут протекать реакции окисления электрода 1 (анод) и восстановления катионов на электроде 2 (катод). Анод будет заряжен отрицательно, катод положительно. Электроны с электрода 2 (анод) по внешней цепи переходят на электрод 1 (катод):
анод(-): Me1 ® (Men+)1 + nē
катод(+): (Men+)2 + nē ® Me2
Суммарная реакция: Me1 + (Men+)2 ® (Men+)1 + Me2 .
Для того чтобы протекал вынужденный процесс (DG>0), т. е. электроны двигались в обратную сторону от электрода 1 на электрод 2, необходимо во внешнюю цепь включить источник электрической энергии, причем, электрод 2 (анод) должен быть заряжен положительно, а электрод 1 (катод) отрицательно (jк < jа). При этом напряжение источника (U) должно быть больше, чем разность равновесных потенциалов электродов: U > j2 – j1.
В этом случае электродные равновесия будут смещаться в обратную сторону и на электродах будут протекать реакции:
анод(+): Me2 ® (Men+)2 + nē
катод(-): (Men+)1 + nē ® Me1
Суммарная реакция: Me2 + (Men+)1 ® (Men+)2 + Me1.
 Для электрохимической системы, составленной из электродов первого рода, электролиз является обратным для процесса работы гальванического элемента. Если j2 > j1, то:
Для электрохимической системы, составленной из электродов первого рода, электролиз является обратным для процесса работы гальванического элемента. Если j2 > j1, то:
Таким образом, для осуществления электролиза необходимо, чтобы напряжение внешнего источника тока (U) было больше электродвижущей силы гальванического элемента (E): U>E. Минимальное значение напряжения внешнего источника тока, при котором возможен электролиз (U0 = E), называется обратимым напряжением разложения электролита.
 Электрохимическая система, в которой осуществляют электролиз, называется электролизером. Он состоит из двух электродов, помещенных в электролит (рис.8.10). Электрод, подключенный к отрицательному полюсу внешнего источника постоянного тока – катод (–), на нем происходит реакция восстановления. Положительный электрод – анод (+), на нем происходит реакция окисления.
Электрохимическая система, в которой осуществляют электролиз, называется электролизером. Он состоит из двух электродов, помещенных в электролит (рис.8.10). Электрод, подключенный к отрицательному полюсу внешнего источника постоянного тока – катод (–), на нем происходит реакция восстановления. Положительный электрод – анод (+), на нем происходит реакция окисления.
Рис. 8‑10 Схема электролизера
Часто для исключения взаимодействия между продуктами электролиза электролизер разделяют полупроницаемой перегородкой.
Если в электролите имеется несколько ионов или молекул, то последовательность их превращения на электродах будет определяться величинами соответствующих электродных потенциалов.
На катоде в первую очередь восстанавливаются более сильные окислители (Oxi), т. е. частицы с большим значением электродного потенциала:
Oxi+nē ® Redi; 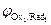 >
> 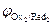 >
> 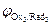 > …>
> …> 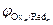 .
.
На аноде в первую очередь будут окисляться частицы (Redi) с меньшим значением электродного потенциала.
Redi ® Oxi + nē; 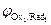 <
< 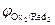 <
< 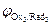 <…<
<…< 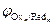 .
.
Дата добавления: 2017-02-20; просмотров: 3210;
